Valutazione Nocicettiva Trigeminale nei pazienti con DTM attraverso lo studio dei Potenziali Evocati da Laser CO2 e dei Periodi Silenti da Laser nel Massetere: differenze tra le versioni
Creata pagina con " {{main menu it |link to German= Hauptseite |link to Spanish= Pàgina Principal |link to French= Page d'accueil |link to Italian= Introduzione |link to English= Introduction }} <div class="chapter-content"> {{ArtBy| | autore = Antonietta Romaniello | autore2 = | autore3 = }} ===Introduction=== The term temporomandibular dysfunction (TMD) refers to a group of painful syndromes affecting the masticatory muscles and the temporomandibular joint (TMJ)<ref name="Dworkin19..." |
Nessun oggetto della modifica |
||
| Riga 1: | Riga 1: | ||
{{main menu it | {{main menu it | ||
|link to German= Hauptseite | |link to German= Hauptseite | ||
| Riga 16: | Riga 15: | ||
=== | ===Introduzione=== | ||
Il termine disfunzione temporomandibolare (TMD) si riferisce a un gruppo di sindromi dolorose che colpiscono i muscoli masticatori e l'articolazione temporomandibolare (ATM)<ref name="Dworkin1992">Dworkin SF, LeResche L. Research diagnostic criteria for temporomandibular disorders: review, criteria, examinations, and specifications. J Craniomandib Disord 1992; 6: 301-355.</ref>. Le classificazioni nosografiche della TMD variano ampiamente poiché possono coinvolgere diversi meccanismi fisiopatologici, e i fattori eziologici sono spesso sconosciuti<ref name="Green2000">Green S. Case presentation: resolution of an oral lesion as a result of orofacial myofunctional therapy. Int J Orofacial Myology 2000; 26: 53-56.</ref>. Molte delle ipotesi proposte per spiegare la sua fisiopatologia e eziologia rimangono in gran parte non dimostrate<ref name="Fricton1995">Fricton JR, Dubner R. Orofacial Pain and Temporomandibular Disorders, Advances in Pain Research and Therapy, vol. 21, Raven Press, New York; 1995.</ref><ref name="Sessle1995">Sessle BJ, Bryant PS, Dionne RA. Temporomandibular Disorders and Related Pain Conditions, Progress in Pain Research and Management, vol. 4, IASP Press, Seattle, WA, 1995.</ref>. Alterazioni elettromiografiche (EMG) dell'attività volontaria o riflessa dei muscoli masticatori sono state spesso riscontrate in associazione con la TMD; tuttavia, gli studi EMG non hanno fornito criteri affidabili né chiarito la patogenesi di questa sindrome controversa<ref name="Svensson2001">Svensson P, Graven-Nielsen T. Craniofacial muscle pain: review of mechanisms and clinical manifestations. J Orofacial Pain 2001; 15: 117-145.</ref>. | |||
Studi recenti hanno contraddetto l'ipotesi di iperattività muscolare o di uno stato di iperattività del sistema nervoso centrale nei pazienti con TMD<ref name="Lund1991">Lund JP, Donga R, Widmer CG, Stohler CS. The pain-adaptation model: a discussion of the relationship between chronic musculoskeletal pain and motor activity. Can J Physiol Pharmacol 1991; 69: 683-694.</ref><ref name="Cruccu1997">Cruccu G, Frisardi G, Pauletti G, Romaniello A, Manfredi M. Excitability of the central masticatory pathways in patients with painful temporomandibular disorders. Pain 1997; 73: 447-454.</ref><ref name="Svensson2000">Svensson P, Arendt-Nielsen L. Clinical and experimental aspects of temporomandibular disorders. Curr Rev Pain 2000; 4: 158-165.</ref>. Studi mirati a valutare il sistema somatosensoriale nei pazienti con TMD hanno prodotto risultati contrastanti riguardo all'estensione e alla rilevazione delle alterazioni della sensibilità somatica, riportando ipersensibilità, iposensibilità o nessuna alterazione<ref name="Svensson2001" /><ref name="Maixner1995">Maixner W, Fillingim R, Booker D, Sigurdsson A. | |||
```it | |||
Sensibilità dei pazienti con disturbi temporomandibolari dolorosi al dolore evocato sperimentalmente. Pain 1995; 63: 341-351.</ref><ref name="Maixner1998">Maixner W, Fillingim R, Sigurdsson A, Kincaid S, Silva S. Sensibilità dei pazienti con disturbi temporomandibolari dolorosi al dolore evocato sperimentalmente: evidenza di una sommatoria temporale alterata del dolore. Pain 1998; 76: 71-81.</ref>. Uno studio sperimentale condotto su volontari sani ha recentemente dimostrato che il dolore sperimentale tonico nel territorio trigeminale riduce i potenziali evocati dal laser CO2 (LEPs) e i periodi silenti del laser (LSPs)<ref name="RomanielloSubmitted">Romaniello A, Arendt-Nielsen L, Cruccu G, Svensson P. Modulazione dei potenziali evocati dal laser trigeminale e dei periodi silenti del laser mediante dolore sperimentale omotopico. Pain, submitted.</ref>. Poiché lo stimolo laser attiva selettivamente afferenti di piccolo calibro (fibre A-delta e C) e valuta la funzione degli afferenti nocicettivi<ref name="Bromm1991">Bromm B, Treede RD. Potenziali cerebrali evocati dal laser nella valutazione della sensibilità al dolore cutaneo in soggetti normali e pazienti. Rev Neurol (Paris) 1991; 147: 625-643.</ref><ref name="Cruccu1999">Cruccu G, Romaniello A, Amantini A, Lombardi M, Innocenti P, Manfredi M. Valutazione della funzione delle piccole fibre trigeminali: risposte cerebrali e riflesse evocate dalla stimolazione laser CO2. Muscle Nerve 1999; 22: 508-516.</ref><ref name="Magerl1999">Magerl W, Ali Z, Ellrich J, Meyer RA, Treede RD. Componenti delle fibre C e A delta dei potenziali cerebrali evocati dal calore in soggetti umani sani. Pain 1999; 82: 127-137.</ref>, gli autori hanno concluso che il dolore tonico induce ipoeccitabilità del sistema nocicettivo trigeminale. | |||
L'obiettivo principale di questo studio era testare l'ipotesi che un gruppo ben definito di pazienti con TMD con dolore craniofacciale cronico unilaterale mostri iposensibilità agli stimoli nocicettivi fasici applicati nell'area trigeminale. In secondo luogo, abbiamo investigato se i circuiti riflessi del tronco encefalico che mediano i LSP siano modulati dal dolore craniofacciale cronico. | |||
===Materiali e Metodi=== | |||
====Soggetti==== | |||
Abbiamo studiato un totale di 15 pazienti (12 donne, 3 uomini) di età compresa tra 27 e 55 anni (età media ± SD: 39,8 ± 10,4) con una storia di dolore unilaterale nei muscoli temporomandibolari o nell'area dell'ATM, e, se presente, tenerezza dei muscoli masticatori su un solo lato. I criteri di inclusione per i pazienti con TMD erano: 1) diagnosi primaria di dolore miofasciale e/o artralgia secondo i Criteri Diagnostici di Ricerca (RDC)<ref name="Dworkin1992" />; | |||
2) dolore che coinvolge il muscolo massetere e/o l'area dell'ATM; 3) durata del dolore di almeno 6 mesi e un'intensità media settimanale del dolore di almeno 3 cm su una scala analogica visiva (VAS) da 0 a 10 cm. I criteri di esclusione includevano: artrite reumatoide, lupus eritematoso sistemico, artrite psoriasica, fibromialgia e lesioni da colpo di frusta. | |||
Inoltre, 30 soggetti di controllo sani comparabili per età e sesso al gruppo di pazienti (21 donne e 9 uomini), di età compresa tra 24 e 60 anni (età media ± | |||
``` | |||
SD: 43,2 ± 12,8), hanno partecipato allo studio. I soggetti del gruppo di controllo non hanno riportato alcuna storia di dolore craniofacciale o cervicale. | |||
==== | ====Potenziali Evocati da Laser (LEPs)==== | ||
Un stimolatore laser a CO2 (Neurolas, Electronic Engineering, Firenze, Italia) è stato utilizzato per registrare i LEPs. Brevi stimoli laser (10,6 μm; intensità 1,5-15 W; durata 10-15 ms; diametro 2,5 mm) sono stati somministrati alla regione periorale (V2/V3). Per evitare lesioni cutanee e affaticamento dei nocicettori, gli stimoli laser sono stati somministrati in punti diversi all'interno di aree contigue, con un intervallo interstimolo di 10-30 secondi. La soglia percettiva (PTh) è stata determinata utilizzando il metodo dei limiti attraverso due serie di stimoli di intensità crescente e decrescente. L'intensità utilizzata per la registrazione dei LEP era 1,5 x PTh. I LEP sono stati registrati utilizzando elettrodi di superficie al vertice (Cz) con riferimenti biaurali (A1, A2) e registrazione simultanea dell'elettrooculogramma. Due blocchi di 8-12 tracciati ciascuno sono stati mediati. I segnali sono stati amplificati, filtrati (0,5-50 Hz) e memorizzati su un analizzatore di bio-potenziali (Premiere, Medelec, UK). Per ciascun blocco, sono stati misurati la latenza delle componenti N e P e l'ampiezza picco-picco. I tracciati contaminati da artefatti oculari sono stati esclusi dall'analisi finale. Dopo ciascun blocco, ai pazienti è stato chiesto di riportare la percezione soggettiva dell'intensità dello stimolo laser utilizzando una scala analogica 0-10. La durata totale dell'attività elettroencefalografica registrata era di 1000 ms (post-stimolo). | |||
=== | ====Periodi Silenti da Laser (LSP)==== | ||
==== | I periodi silenti da laser nel muscolo massetere sono stati registrati utilizzando lo stesso stimolatore impiegato per i LEP. I segnali elettromiografici (EMG) sono stati registrati bipolarmente utilizzando elettrodi di superficie applicati bilateralmente sui muscoli masseteri. Le tecniche standard riportate in studi precedenti<ref name="Cruccu1986">Cruccu G, Agostino R, Lahuerta J, Manfredi M. Inhibition of jaw-closing muscles by electrical stimulation of the ophthalmic division in man. Brain Res 1986; 371: 298-304.</ref><ref name="Ongerboer1993">Ongerboer de Visser BW, Cruccu G. Neurophysiologic examination of the trigeminal, facial, hypoglossal, and spinal accessory nerves in cranial neuropathies and brain stem disorders. In: Brown WF, Bolton CF (eds). Clinical electromyography. Butterworth-Heinemann, Boston, 1993: 61-92.</ref> sono state utilizzate per la registrazione e la misurazione dei LSP. Dodici tracciati sono stati registrati da ciascun lato sia nei pazienti che nei soggetti di controllo, con un intervallo interstimolo di 10-30 secondi. L'area di attività EMG per i 100 ms precedenti lo stimolo è stata misurata su segnali mediati e rettificati. La durata totale dell'attività EMG registrata era di 100 ms pre-stimolo e 300 ms post-stimolo. | ||
In | |||
==== | ====Analisi Statistica==== | ||
I valori medi e le deviazioni standard sono riportati nel testo, nella tabella e nella figura. La latenza delle componenti N e P e l'ampiezza picco-picco dei LEP sono state analizzate utilizzando l'analisi della varianza (ANOVA, modello misto) tra gruppi (soggetti di controllo e pazienti con TMD) e all'interno dei gruppi (tra destra e | |||
left sides and between painful and non-painful sides). Lo stesso modello statistico è stato utilizzato per l'analisi LSP. I dati appaiati sono stati analizzati utilizzando il test t di Student. | |||
====Laser | ===Risultati=== | ||
In | ====Soggetti==== | ||
File:Figure 1 (Romaniello).jpg|''' | In linea con i criteri diagnostici per TMD (RDC), 10 pazienti sono stati classificati tra TMD con dolore miofasciale e artralgia, e i restanti 5 sono stati classificati tra TMD con dolore miofasciale dei muscoli craniofacciali. | ||
====Potenziali Evocati da Laser (LEPs)==== | |||
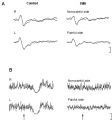
Non sono state trovate differenze significative nel PTh tra i due gruppi e i lati (P > 0,20). Tuttavia, i pazienti con TMD percepivano lo stimolo sovrasoglia utilizzato per la registrazione dei LEP come meno intenso sul lato doloroso rispetto al lato non doloroso (P < 0,05). La latenza delle componenti N e P nei pazienti era comparabile a quella dei controlli sani (Figura 1). | |||
Al contrario, l'ampiezza dei LEP era inferiore nei pazienti rispetto ai soggetti sani, del 30-50% (P < 0,001). Inoltre, nei pazienti, la riduzione dell'ampiezza dei LEP era più pronunciata sul lato doloroso (P < 0,001) (Figura 1A). | |||
====Periodi Silenti da Laser (LSP)==== | |||
In tutti i soggetti di controllo, stimoli laser ad alta intensità (circa 4 x PTh) somministrati alla regione periorale bilateralmente hanno provocato una fase di soppressione EMG durante la contrazione del muscolo massetere. La latenza (70,2 ± 6,8 ms) e la durata (50 ± 9,8 ms) degli LSP erano simmetriche nei soggetti di controllo. Nei pazienti, l'LSP era assente bilateralmente in 12 di loro, indipendentemente dal lato stimolato (Figura 1B). Nei restanti 3 pazienti, 2 (TMD con dolore miofasciale e artralgia) presentavano LSP solo sul lato non doloroso, e 1 (TMD con dolore miofasciale) aveva LSP normali e simmetrici. Inoltre, l'attività EMG pre-stimolo nei pazienti con TMD era ridotta del 50% sul lato doloroso e del 15% sul lato non doloroso rispetto ai soggetti di controllo.<gallery mode="slideshow"> | |||
File:Figure 1 (Romaniello).jpg|'''Figura 1:''' A. Esempio di potenziali evocati da laser (LEPs) da stimolazione periorale (V2/V3) in un soggetto sano e in un paziente con TMD. L'ampiezza dei LEP è significativamente ridotta nei pazienti con TMD (P < 0,001). La figura mostra la media sovrapposta di 2 blocchi di 8-12 tracce ciascuno. Tempo di analisi: 1000 ms; calibrazione verticale: 20 μV. B. Esempio di periodo silente da laser (LSP) registrato dai muscoli masseteri destro (R) e sinistro (L) in un soggetto sano e in un paziente con TMD con dolore craniofacciale sul lato sinistro. Nel paziente con TMD, l'attività EMG pre-stimolo è ridotta sul lato doloroso e non sono stati registrati LSP bilateralmente. Tempo di analisi: 100 ms pre-stimolo; 300 ms post-stimolo. Calibrazione verticale: 200 μV. | |||
</gallery> | </gallery> | ||
=== | ===Discussione=== | ||
=== | ===Modulazione dei Potenziali Evocati da Laser (LEPs)=== | ||
Diversi studi hanno descritto la modulazione delle risposte cerebrali evocate da stimoli nocicettivi fasici sperimentali in pazienti con vari tipi di dolore cronico. Nei pazienti con la cosiddetta "sindrome del dolore cronico benigno intrattabile," è stata osservata una riduzione dell'ampiezza dei LEP rispetto ai controlli<ref>Coger RW, Kenton B, Pinsky JJ, Crue BL, Carmon A, | |||
Friedman Y. Potenziali evocati somatosensoriali e stimolazione nociva in pazienti con sindromi dolorose intrattabili non oncologiche. Psychiatry Res 1980; 2: 279-294.</ref>. L'ampiezza dei LEP è ridotta anche nei pazienti con dolore cervico-brachiale<ref>Gibson SJ, LeVasseur SA, Helme RD. Risposte cerebrali evento-correlate indotte da stimolazione laser a CO2 in soggetti affetti da sindrome cervico-brachiale. Pain 1991; 47: 173-182.</ref> e dolore centrale<ref>Casey KL, Beydoun A, Boivie J, Sjolund B, Holmgren H, Leijon G, Morrow TJ, Rosen I. Potenziali cerebrali evocati dal laser e funzione sensoriale in pazienti con dolore centrale. Pain 1996; 64: 485-491.</ref>. Uno studio condotto su pazienti con "sindrome della bocca urente cronica" ha mostrato una ridotta sensibilità agli stimoli laser sia nell'area dolorosa che nelle aree non dolorose<ref>Svensson P, Bjerring P, Arendt-Nielsen L, Kaaber S. Soglie sensoriali e del dolore alla stimolazione laser con argon orofacciale in pazienti con sindrome della bocca urente cronica. Clin J Pain 1993; 9:207-215.</ref>. I dati collettivi suggeriscono un'inibizione degli input nocicettivi fasici nei pazienti con dolore cronico. I risultati di questo studio su pazienti con dolore craniofacciale cronico forniscono ulteriore supporto a questa interpretazione. | |||
I pazienti con TMD hanno mostrato una ridotta sensibilità al dolore sperimentale fasico, poiché lo stimolo laser soprasoglia è stato percepito come meno intenso sul lato doloroso rispetto al lato non doloroso, e allo stesso tempo, l'ampiezza dei LEP è stata significativamente ridotta. Queste osservazioni suggeriscono un'ipoattività del sistema nocicettivo trigeminale che proietta alla corteccia nei pazienti con TMD. Non è possibile determinare a quale livello delle vie centrali avvenga questa modulazione. Tuttavia, il coinvolgimento periferico è improbabile poiché la soglia percettiva nei pazienti con TMD non differiva da quella dei controlli. È probabile che l'inibizione dell'ampiezza dei LEP rappresenti un'alterazione nella valutazione cognitiva delle informazioni nocicettive, che potrebbe derivare sia da un processo di adattamento psicologico, dove il disagio causato dal dolore sperimentale fasico è ridotto a causa del confronto con il disagio considerevolmente maggiore causato dal dolore clinico, sia da un fenomeno fisiologico di inibizione compensatoria delle informazioni nocicettive<ref name="Gracely1984">Gracely RH. Quantificazione soggettiva della percezione del dolore. In: Bromm B (ed.), Pain Measurement in Man: Neurophysiological Correlates of Pain, Elsevier, Amsterdam, 1984: 111-137.</ref>. | |||
È stato ipotizzato<ref name="Langermark1989">Langermark M, Jensen K, Jensen TS, Olesen J. Soglie del dolore da pressione e soglie nocicettive termiche nella cefalea tensiva cronica. Pain 1989; 38: 203-210.</ref> che il grado di coinvolgimento organico rispetto al coinvolgimento psicologico in diverse condizioni di dolore cronico potrebbe spiegare i risultati contrastanti ottenuti in vari studi. Pazienti con paraplegia dolorosa<ref name="Hazouri1950">Hazouri LA, Mueller AD. Studi sulla soglia del dolore in pazienti paraplegici. | |||
Arch Neurol Psychiatry 1950; 64: 607-613.</ref>, dolore neuropatico<ref name="Callagan1978">Callaghan M, Sternbach RA, Nyquist JK, Timmermans G. Changes in somatic sensitivity during transcutaneous electrical analgesia. Pain 1978; 5:115-127.</ref>, e dolore lombare<ref name="Naliboff1981">Naliboff BD, Cohen MJ, Schandler SL, Heinrich RL. Signal detection and threshold measures for chronic low back pain patients, chronic illness, and cohort controls to radiant heat stimuli. J Abnorm Psychol 1981; 90: 271-274.</ref><ref name="Cohen1983">Cohen MJ, Naliboff BD, Schandler SL, Heinrich RL. Signal detection and threshold measures to loud tones and radiant heat in chronic low back pain patients and cohort controls. Pain 1983; 16: 245-252.</ref> mostrano un aumento della soglia percettiva per gli stimoli dolorosi rispetto ai controlli. Al contrario, condizioni di dolore in cui si ritiene che i fattori psicologici siano predominanti, come la fibromialgia<ref name="Quimby1988">Quimby LG, Block SR, Gratwick GM. Fibromyalgia: generalized pain intolerance and manifold symptom reporting. J Rheumatol 1988; 15: 1264-1270.</ref><ref name="Scudd1987">Scudd RA, Rollman GB, Harth M, McCain GA. Pain perception and personality measures as discriminators in the classification of fibrositis. J Rheumatol 1987; 14: 563-569.</ref>, o il dolore psichiatrico<ref name="Merskey1964">Merskey H. The effect of chronic pain upon response to noxious stimuli by psychiatric patients. J Psychosom Res 1964; 8: 405-419.</ref><ref name="MerskeyEvans1975">Merskey H, Evans PR. Variations in pain complaint threshold in psychiatric and neurological patients with pain. Pain 1975; 1: 73-79.</ref>, tendono ad essere associate a una riduzione della soglia percettiva. Nei pazienti con TMD, Maixner et al.<ref name="Maixner1995" /><ref name="Maixner1998" /> hanno descritto una maggiore sensibilità al dolore sperimentale e hanno suggerito che il dolore associato al TMD possa essere considerato un disturbo psicologico associato a un'alterazione dei meccanismi inibitori centrali, che di conseguenza induce una facilitazione dell'attività del sistema nocicettivo. Al contrario, uno studio condotto da Cruccu et al.<ref name="Cruccu1997" /> sui pazienti con TMD non ha confermato uno stato di iperattività centrale, poiché i pazienti con TMD avevano un'eccitabilità normale della formazione reticolare del tronco encefalico e delle proiezioni corticoreticolari. È probabile che differenze sperimentali, come l'uso di diversi tipi di stimoli nocicettivi sperimentali e la stimolazione di diverse aree, possano portare a risultati diversi in vari studi. | |||
===Modulazione del Periodo Silente Laser (LSP)=== | |||
Gli studi sull'attività EMG dei muscoli affetti da dolore hanno prodotto risultati contrastanti, e la letteratura sui cambiamenti EMG nel TMD fornisce dati inconcludenti<ref name="Stohler1995">Stohler CS. Craniofacial Pain and Motor Function, Exp Brain Res 1995; 99: 46-53.</ref><ref name="Svensson2000" />. Tuttavia, ci sono prove che il dolore altera la performance motoria facilitando il motoneurone quando il muscolo | |||
agisce come un agonista e lo inibisce quando il muscolo agisce come un antagonista<ref name="Lund1991" />. La modulazione della performance motoria è stata osservata in vari tipi di dolore cronico e probabilmente riflette un processo adattativo<ref name="Lund1991" />. A livello trigeminale, gli input nocicettivi dai muscoli masticatori riducono sia l'ampiezza che la velocità dei movimenti volontari della mandibola<ref name="Lund1991" /> e dei movimenti masticatori<ref>Svensson P, Arendt-Nielsen L, Bjerring P, Bak P, Hjorth T, Troest T. Human mastication modulated by experimental trigeminal and extra-trigeminal painful stimuli. J Oral Rehabil 1996a; 23: 838-848.</ref><ref>Svensson P, Arendt-Nielsen L, Houe L. Sensory-motor interactions of human experimental unilateral jaw muscle pain: a quantitative analysis. Pain 1996b; 64: 241-249.</ref>. La riduzione dell'attività EMG pre-stimolo osservata nel nostro studio è coerente con la teoria sopra menzionata. La riduzione unilaterale dell'attività EMG pre-stimolo era associata a una significativa inibizione bilaterale delle vie riflesse del tronco encefalico che mediano le risposte riflesse nocicettive (gli LSP erano assenti bilateralmente nella maggior parte dei pazienti con TMD). È improbabile che l'assenza di LSP sia stata causata dalla ridotta attività EMG pre-stimolo. Miles e Turker<ref name=":0">Miles TS, Turker KS. Does reflex inhibition of motor units follow the "size principle"? Exp Brain Res 1986; 62: 443-445. </ref> hanno dimostrato che la suscettibilità dei motoneuroni all'inibizione è proporzionale alla loro frequenza di scarica. Pertanto, a parità di intensità dello stimolo, dovrebbe essere più facile inibire i motoneuroni con livelli di scarica pre-stimolo inferiori<ref name=":0" />. Quindi, l'assenza di LSP nei pazienti con TMD è stata molto probabilmente causata dal dolore cronico e non dalla ridotta attività EMG pre-stimolo. | |||
L'LSP è un riflesso puramente nocicettivo<ref name="Ellrich1997">Ellrich J, Hopf HC, Treede RD. Nociceptive masseter inhibitory reflexes evoked by laser radiant heat and electrical stimuli. Brain Res 1997; 764: 214-220.</ref><ref name="CruccuRomaniello1998">Cruccu G, Romaniello A. Jaw-opening reflex after CO2 laser stimulation of the perioral region in man. Exp Brain Res 1998; 118: 564-568.</ref>, il cui circuito rimane parzialmente sconosciuto. È stato suggerito un centro comune, rappresentato dai neuroni a larga gamma dinamica (WDR) del nucleo reticolare, corrispondente alla lamina V del nucleo subcaudale<ref name="Sessle1999">Sessle BJ. Neural mechanisms and pathways in craniofacial pain. Can J Neurol Sci 1999; 26: 7-11.</ref><ref name="CruccuRomaniello1998" />, capace di mediare il secondo periodo silente del massetere evocato elettricamente (SP2), il singolo periodo silente evocato dalla stimolazione del nervo sopraorbitario e l'LSP. Studi sperimentali hanno dimostrato che l'SP2 è modulato da stimoli dolorosi sperimentali applicati sia nell'area trigeminale<ref name="Wang1999">Wang K, Svensson P, Arendt-Nielsen L. Modulation of exteroceptive suppression periods in human jaw-closing muscles by local and remote experimental muscle pain. Pain 1999; 82: 253-262.</ref> | |||
e in aree extra-trigeminali<ref name="Bendtsen1993">Bendtsen L, Jensen R, Brennum J, Arendt-Nielsen L, Olesen J. Exteroceptive suppression periods in jaw-closing muscles. Variability and relation to experimental pain and sustained muscle contraction. Cephalalgia 1993; 13: 184-191.</ref><ref name="Bendtsen1996">Bendtsen L, Jensen R, Brennum J, Arendt-Nielsen L, Olesen J. Exteroceptive suppression of temporal muscle activity is normal in chronic tension-type headache and not related to actual headache state. Cephalalgia 1996; 16: 251-256.</ref><ref name="Cadden1994">Cadden SW, Newton JP. The effects of inhibitory controls triggered by heterotopic noxious stimuli on a jaw reflex evoked by perioral stimuli in man. Arch Oral Biol 1994; 39: 473-480.</ref><ref name="Schoenen1994">Schoenen J, Wang W, Gerard P. Modulation of temporalis muscle exteroceptive suppression by limb stimuli in normal man. Brain Res 1994; 657: 214-220.</ref>. Al contrario, i dati nei pazienti con TMD<ref name="DeLaat1998">De Laat A, Svensson P, Macaluso GM. Are jaw and facial reflexes modulated during clinical or experimental orofacial pain? J Orofac Pain 1998; 12: 260-271.</ref>, così come in altri pazienti con dolore craniofacciale cronico<ref name="Schoenen1993">Schoenen J. Exteroceptive suppression of temporalis muscle activity: Methodological aspects and pathophysiological implications. Cephalalgia 1993; 13: 82-91.</ref>, rimangono controversi. | |||
LSP | Recentemente, è stato dimostrato che l'LSP è fortemente soppresso dal dolore trigeminale sperimentale tonico, sia muscolare che cutaneo<ref name="RomanielloSubmitted" />. In questo studio, l'assenza di LSP in 12 su 15 pazienti suggerisce una marcata ipoattività delle vie del tronco encefalico che mediano l'LSP. L'LSP è stato soppresso in misura considerevolmente maggiore rispetto agli LEP. È possibile che la via riflessa sia soggetta a una doppia inibizione: una mediata da un meccanismo simile a quello coinvolto negli LEP (vedi la sezione precedente) e un'altra mediata da un meccanismo di inibizione segmentale che agisce sul circuito riflesso LSP del tronco encefalico. L'inibizione segmentale può avvenire presinapticamente, sulla fibra afferente primaria, o postsinapticamente nel circuito interneuronale. Diversi studi hanno dimostrato la depolarizzazione presinaptica (PAD) nel nucleo trigeminale dopo uno stimolo trigeminale condizionante<ref name="DarianSmith1965">Darian-Smith I. Presynaptic component in the afferent inhibition observed within trigeminal brain-stem nuclei of the cat. J Neurophysiol 1965; 28: 695-709.</ref><ref name="Hu1988">Hu JW, Sessle BJ. Properties of functionally identified nociceptive and nonnociceptive facial primary afferents and presynaptic excitability changes induced in their brain stem endings by raphe and orofacial stimuli in cats. Exp Neurol 1988; 101: 385-399.</ref>. Tuttavia, mentre la PAD può giocare un ruolo nella modulazione dell'LSP, il solo meccanismo di inibizione presinaptica non è sufficiente a spiegare la soppressione bilaterale dell'LSP nei nostri pazienti con dolore unilaterale. More | ||
probabilmente, l'effetto inibitorio indotto dal dolore si è verificato a livello interneuronale, lungo il percorso del riflesso centrale. A questo livello, l'effetto indotto dal dolore può avere un impatto bilaterale, poiché è stato dimostrato che uno stimolo doloroso condizionante può indurre un'inibizione segmentale controlaterale sui neuroni del corno dorsale, sia sui neuroni specifici nocicettivi che sui neuroni a gamma dinamica ampia<ref name="Fitzgerald1982">Fitzgerald M. The contralateral input to the dorsal horn of the spinal cord in the decerebrate spinal rat. Brain Res 1982; 236: 257-287.</ref>. | |||
In | In conclusione, questo studio ha dimostrato che nei pazienti con TMD con dolore cronico unilaterale, sia gli input nocicettivi diretti alla corteccia che il circuito riflesso nocicettivo del tronco encefalico sono inibiti. Sebbene questi risultati suggeriscano una disfunzione del sistema nocicettivo che media e integra gli input nocicettivi fasici, non è possibile affermare se questa disfunzione giochi un ruolo nella fisiopatologia del TMD o se sia piuttosto una conseguenza del dolore cronico. | ||
{{Bib}} | {{Bib}} | ||
Versione attuale delle 00:25, 3 mag 2025
Valutazione Nocicettiva Trigeminale nei pazienti con DTM attraverso lo studio dei Potenziali Evocati da Laser CO2 e dei Periodi Silenti da Laser nel Massetere
Article by: Antonietta Romaniello
|
Introduzione
Il termine disfunzione temporomandibolare (TMD) si riferisce a un gruppo di sindromi dolorose che colpiscono i muscoli masticatori e l'articolazione temporomandibolare (ATM)[1]. Le classificazioni nosografiche della TMD variano ampiamente poiché possono coinvolgere diversi meccanismi fisiopatologici, e i fattori eziologici sono spesso sconosciuti[2]. Molte delle ipotesi proposte per spiegare la sua fisiopatologia e eziologia rimangono in gran parte non dimostrate[3][4]. Alterazioni elettromiografiche (EMG) dell'attività volontaria o riflessa dei muscoli masticatori sono state spesso riscontrate in associazione con la TMD; tuttavia, gli studi EMG non hanno fornito criteri affidabili né chiarito la patogenesi di questa sindrome controversa[5].
Studi recenti hanno contraddetto l'ipotesi di iperattività muscolare o di uno stato di iperattività del sistema nervoso centrale nei pazienti con TMD[6][7][8]. Studi mirati a valutare il sistema somatosensoriale nei pazienti con TMD hanno prodotto risultati contrastanti riguardo all'estensione e alla rilevazione delle alterazioni della sensibilità somatica, riportando ipersensibilità, iposensibilità o nessuna alterazione[5][9][10]. Uno studio sperimentale condotto su volontari sani ha recentemente dimostrato che il dolore sperimentale tonico nel territorio trigeminale riduce i potenziali evocati dal laser CO2 (LEPs) e i periodi silenti del laser (LSPs)[11]. Poiché lo stimolo laser attiva selettivamente afferenti di piccolo calibro (fibre A-delta e C) e valuta la funzione degli afferenti nocicettivi[12][13][14], gli autori hanno concluso che il dolore tonico induce ipoeccitabilità del sistema nocicettivo trigeminale.
L'obiettivo principale di questo studio era testare l'ipotesi che un gruppo ben definito di pazienti con TMD con dolore craniofacciale cronico unilaterale mostri iposensibilità agli stimoli nocicettivi fasici applicati nell'area trigeminale. In secondo luogo, abbiamo investigato se i circuiti riflessi del tronco encefalico che mediano i LSP siano modulati dal dolore craniofacciale cronico.
Materiali e Metodi
Soggetti
Abbiamo studiato un totale di 15 pazienti (12 donne, 3 uomini) di età compresa tra 27 e 55 anni (età media ± SD: 39,8 ± 10,4) con una storia di dolore unilaterale nei muscoli temporomandibolari o nell'area dell'ATM, e, se presente, tenerezza dei muscoli masticatori su un solo lato. I criteri di inclusione per i pazienti con TMD erano: 1) diagnosi primaria di dolore miofasciale e/o artralgia secondo i Criteri Diagnostici di Ricerca (RDC)[1]; 2) dolore che coinvolge il muscolo massetere e/o l'area dell'ATM; 3) durata del dolore di almeno 6 mesi e un'intensità media settimanale del dolore di almeno 3 cm su una scala analogica visiva (VAS) da 0 a 10 cm. I criteri di esclusione includevano: artrite reumatoide, lupus eritematoso sistemico, artrite psoriasica, fibromialgia e lesioni da colpo di frusta.
Inoltre, 30 soggetti di controllo sani comparabili per età e sesso al gruppo di pazienti (21 donne e 9 uomini), di età compresa tra 24 e 60 anni (età media ± ```
SD: 43,2 ± 12,8), hanno partecipato allo studio. I soggetti del gruppo di controllo non hanno riportato alcuna storia di dolore craniofacciale o cervicale.
Potenziali Evocati da Laser (LEPs)
Un stimolatore laser a CO2 (Neurolas, Electronic Engineering, Firenze, Italia) è stato utilizzato per registrare i LEPs. Brevi stimoli laser (10,6 μm; intensità 1,5-15 W; durata 10-15 ms; diametro 2,5 mm) sono stati somministrati alla regione periorale (V2/V3). Per evitare lesioni cutanee e affaticamento dei nocicettori, gli stimoli laser sono stati somministrati in punti diversi all'interno di aree contigue, con un intervallo interstimolo di 10-30 secondi. La soglia percettiva (PTh) è stata determinata utilizzando il metodo dei limiti attraverso due serie di stimoli di intensità crescente e decrescente. L'intensità utilizzata per la registrazione dei LEP era 1,5 x PTh. I LEP sono stati registrati utilizzando elettrodi di superficie al vertice (Cz) con riferimenti biaurali (A1, A2) e registrazione simultanea dell'elettrooculogramma. Due blocchi di 8-12 tracciati ciascuno sono stati mediati. I segnali sono stati amplificati, filtrati (0,5-50 Hz) e memorizzati su un analizzatore di bio-potenziali (Premiere, Medelec, UK). Per ciascun blocco, sono stati misurati la latenza delle componenti N e P e l'ampiezza picco-picco. I tracciati contaminati da artefatti oculari sono stati esclusi dall'analisi finale. Dopo ciascun blocco, ai pazienti è stato chiesto di riportare la percezione soggettiva dell'intensità dello stimolo laser utilizzando una scala analogica 0-10. La durata totale dell'attività elettroencefalografica registrata era di 1000 ms (post-stimolo).
Periodi Silenti da Laser (LSP)
I periodi silenti da laser nel muscolo massetere sono stati registrati utilizzando lo stesso stimolatore impiegato per i LEP. I segnali elettromiografici (EMG) sono stati registrati bipolarmente utilizzando elettrodi di superficie applicati bilateralmente sui muscoli masseteri. Le tecniche standard riportate in studi precedenti[15][16] sono state utilizzate per la registrazione e la misurazione dei LSP. Dodici tracciati sono stati registrati da ciascun lato sia nei pazienti che nei soggetti di controllo, con un intervallo interstimolo di 10-30 secondi. L'area di attività EMG per i 100 ms precedenti lo stimolo è stata misurata su segnali mediati e rettificati. La durata totale dell'attività EMG registrata era di 100 ms pre-stimolo e 300 ms post-stimolo.
Analisi Statistica
I valori medi e le deviazioni standard sono riportati nel testo, nella tabella e nella figura. La latenza delle componenti N e P e l'ampiezza picco-picco dei LEP sono state analizzate utilizzando l'analisi della varianza (ANOVA, modello misto) tra gruppi (soggetti di controllo e pazienti con TMD) e all'interno dei gruppi (tra destra e
left sides and between painful and non-painful sides). Lo stesso modello statistico è stato utilizzato per l'analisi LSP. I dati appaiati sono stati analizzati utilizzando il test t di Student.
Risultati
Soggetti
In linea con i criteri diagnostici per TMD (RDC), 10 pazienti sono stati classificati tra TMD con dolore miofasciale e artralgia, e i restanti 5 sono stati classificati tra TMD con dolore miofasciale dei muscoli craniofacciali.
Potenziali Evocati da Laser (LEPs)
Non sono state trovate differenze significative nel PTh tra i due gruppi e i lati (P > 0,20). Tuttavia, i pazienti con TMD percepivano lo stimolo sovrasoglia utilizzato per la registrazione dei LEP come meno intenso sul lato doloroso rispetto al lato non doloroso (P < 0,05). La latenza delle componenti N e P nei pazienti era comparabile a quella dei controlli sani (Figura 1).
Al contrario, l'ampiezza dei LEP era inferiore nei pazienti rispetto ai soggetti sani, del 30-50% (P < 0,001). Inoltre, nei pazienti, la riduzione dell'ampiezza dei LEP era più pronunciata sul lato doloroso (P < 0,001) (Figura 1A).
Periodi Silenti da Laser (LSP)
In tutti i soggetti di controllo, stimoli laser ad alta intensità (circa 4 x PTh) somministrati alla regione periorale bilateralmente hanno provocato una fase di soppressione EMG durante la contrazione del muscolo massetere. La latenza (70,2 ± 6,8 ms) e la durata (50 ± 9,8 ms) degli LSP erano simmetriche nei soggetti di controllo. Nei pazienti, l'LSP era assente bilateralmente in 12 di loro, indipendentemente dal lato stimolato (Figura 1B). Nei restanti 3 pazienti, 2 (TMD con dolore miofasciale e artralgia) presentavano LSP solo sul lato non doloroso, e 1 (TMD con dolore miofasciale) aveva LSP normali e simmetrici. Inoltre, l'attività EMG pre-stimolo nei pazienti con TMD era ridotta del 50% sul lato doloroso e del 15% sul lato non doloroso rispetto ai soggetti di controllo.Discussione
Modulazione dei Potenziali Evocati da Laser (LEPs)
Diversi studi hanno descritto la modulazione delle risposte cerebrali evocate da stimoli nocicettivi fasici sperimentali in pazienti con vari tipi di dolore cronico. Nei pazienti con la cosiddetta "sindrome del dolore cronico benigno intrattabile," è stata osservata una riduzione dell'ampiezza dei LEP rispetto ai controlli[17]. L'ampiezza dei LEP è ridotta anche nei pazienti con dolore cervico-brachiale[18] e dolore centrale[19]. Uno studio condotto su pazienti con "sindrome della bocca urente cronica" ha mostrato una ridotta sensibilità agli stimoli laser sia nell'area dolorosa che nelle aree non dolorose[20]. I dati collettivi suggeriscono un'inibizione degli input nocicettivi fasici nei pazienti con dolore cronico. I risultati di questo studio su pazienti con dolore craniofacciale cronico forniscono ulteriore supporto a questa interpretazione.
I pazienti con TMD hanno mostrato una ridotta sensibilità al dolore sperimentale fasico, poiché lo stimolo laser soprasoglia è stato percepito come meno intenso sul lato doloroso rispetto al lato non doloroso, e allo stesso tempo, l'ampiezza dei LEP è stata significativamente ridotta. Queste osservazioni suggeriscono un'ipoattività del sistema nocicettivo trigeminale che proietta alla corteccia nei pazienti con TMD. Non è possibile determinare a quale livello delle vie centrali avvenga questa modulazione. Tuttavia, il coinvolgimento periferico è improbabile poiché la soglia percettiva nei pazienti con TMD non differiva da quella dei controlli. È probabile che l'inibizione dell'ampiezza dei LEP rappresenti un'alterazione nella valutazione cognitiva delle informazioni nocicettive, che potrebbe derivare sia da un processo di adattamento psicologico, dove il disagio causato dal dolore sperimentale fasico è ridotto a causa del confronto con il disagio considerevolmente maggiore causato dal dolore clinico, sia da un fenomeno fisiologico di inibizione compensatoria delle informazioni nocicettive[21].
È stato ipotizzato[22] che il grado di coinvolgimento organico rispetto al coinvolgimento psicologico in diverse condizioni di dolore cronico potrebbe spiegare i risultati contrastanti ottenuti in vari studi. Pazienti con paraplegia dolorosa[23], dolore neuropatico[24], e dolore lombare[25][26] mostrano un aumento della soglia percettiva per gli stimoli dolorosi rispetto ai controlli. Al contrario, condizioni di dolore in cui si ritiene che i fattori psicologici siano predominanti, come la fibromialgia[27][28], o il dolore psichiatrico[29][30], tendono ad essere associate a una riduzione della soglia percettiva. Nei pazienti con TMD, Maixner et al.[9][10] hanno descritto una maggiore sensibilità al dolore sperimentale e hanno suggerito che il dolore associato al TMD possa essere considerato un disturbo psicologico associato a un'alterazione dei meccanismi inibitori centrali, che di conseguenza induce una facilitazione dell'attività del sistema nocicettivo. Al contrario, uno studio condotto da Cruccu et al.[7] sui pazienti con TMD non ha confermato uno stato di iperattività centrale, poiché i pazienti con TMD avevano un'eccitabilità normale della formazione reticolare del tronco encefalico e delle proiezioni corticoreticolari. È probabile che differenze sperimentali, come l'uso di diversi tipi di stimoli nocicettivi sperimentali e la stimolazione di diverse aree, possano portare a risultati diversi in vari studi.
Modulazione del Periodo Silente Laser (LSP)
Gli studi sull'attività EMG dei muscoli affetti da dolore hanno prodotto risultati contrastanti, e la letteratura sui cambiamenti EMG nel TMD fornisce dati inconcludenti[31][8]. Tuttavia, ci sono prove che il dolore altera la performance motoria facilitando il motoneurone quando il muscolo
agisce come un agonista e lo inibisce quando il muscolo agisce come un antagonista[6]. La modulazione della performance motoria è stata osservata in vari tipi di dolore cronico e probabilmente riflette un processo adattativo[6]. A livello trigeminale, gli input nocicettivi dai muscoli masticatori riducono sia l'ampiezza che la velocità dei movimenti volontari della mandibola[6] e dei movimenti masticatori[32][33]. La riduzione dell'attività EMG pre-stimolo osservata nel nostro studio è coerente con la teoria sopra menzionata. La riduzione unilaterale dell'attività EMG pre-stimolo era associata a una significativa inibizione bilaterale delle vie riflesse del tronco encefalico che mediano le risposte riflesse nocicettive (gli LSP erano assenti bilateralmente nella maggior parte dei pazienti con TMD). È improbabile che l'assenza di LSP sia stata causata dalla ridotta attività EMG pre-stimolo. Miles e Turker[34] hanno dimostrato che la suscettibilità dei motoneuroni all'inibizione è proporzionale alla loro frequenza di scarica. Pertanto, a parità di intensità dello stimolo, dovrebbe essere più facile inibire i motoneuroni con livelli di scarica pre-stimolo inferiori[34]. Quindi, l'assenza di LSP nei pazienti con TMD è stata molto probabilmente causata dal dolore cronico e non dalla ridotta attività EMG pre-stimolo.
L'LSP è un riflesso puramente nocicettivo[35][36], il cui circuito rimane parzialmente sconosciuto. È stato suggerito un centro comune, rappresentato dai neuroni a larga gamma dinamica (WDR) del nucleo reticolare, corrispondente alla lamina V del nucleo subcaudale[37][36], capace di mediare il secondo periodo silente del massetere evocato elettricamente (SP2), il singolo periodo silente evocato dalla stimolazione del nervo sopraorbitario e l'LSP. Studi sperimentali hanno dimostrato che l'SP2 è modulato da stimoli dolorosi sperimentali applicati sia nell'area trigeminale[38]
e in aree extra-trigeminali[39][40][41][42]. Al contrario, i dati nei pazienti con TMD[43], così come in altri pazienti con dolore craniofacciale cronico[44], rimangono controversi.
Recentemente, è stato dimostrato che l'LSP è fortemente soppresso dal dolore trigeminale sperimentale tonico, sia muscolare che cutaneo[11]. In questo studio, l'assenza di LSP in 12 su 15 pazienti suggerisce una marcata ipoattività delle vie del tronco encefalico che mediano l'LSP. L'LSP è stato soppresso in misura considerevolmente maggiore rispetto agli LEP. È possibile che la via riflessa sia soggetta a una doppia inibizione: una mediata da un meccanismo simile a quello coinvolto negli LEP (vedi la sezione precedente) e un'altra mediata da un meccanismo di inibizione segmentale che agisce sul circuito riflesso LSP del tronco encefalico. L'inibizione segmentale può avvenire presinapticamente, sulla fibra afferente primaria, o postsinapticamente nel circuito interneuronale. Diversi studi hanno dimostrato la depolarizzazione presinaptica (PAD) nel nucleo trigeminale dopo uno stimolo trigeminale condizionante[45][46]. Tuttavia, mentre la PAD può giocare un ruolo nella modulazione dell'LSP, il solo meccanismo di inibizione presinaptica non è sufficiente a spiegare la soppressione bilaterale dell'LSP nei nostri pazienti con dolore unilaterale. More
probabilmente, l'effetto inibitorio indotto dal dolore si è verificato a livello interneuronale, lungo il percorso del riflesso centrale. A questo livello, l'effetto indotto dal dolore può avere un impatto bilaterale, poiché è stato dimostrato che uno stimolo doloroso condizionante può indurre un'inibizione segmentale controlaterale sui neuroni del corno dorsale, sia sui neuroni specifici nocicettivi che sui neuroni a gamma dinamica ampia[47].
In conclusione, questo studio ha dimostrato che nei pazienti con TMD con dolore cronico unilaterale, sia gli input nocicettivi diretti alla corteccia che il circuito riflesso nocicettivo del tronco encefalico sono inibiti. Sebbene questi risultati suggeriscano una disfunzione del sistema nocicettivo che media e integra gli input nocicettivi fasici, non è possibile affermare se questa disfunzione giochi un ruolo nella fisiopatologia del TMD o se sia piuttosto una conseguenza del dolore cronico.
- ↑ 1,0 1,1 Dworkin SF, LeResche L. Research diagnostic criteria for temporomandibular disorders: review, criteria, examinations, and specifications. J Craniomandib Disord 1992; 6: 301-355.
- ↑ Green S. Case presentation: resolution of an oral lesion as a result of orofacial myofunctional therapy. Int J Orofacial Myology 2000; 26: 53-56.
- ↑ Fricton JR, Dubner R. Orofacial Pain and Temporomandibular Disorders, Advances in Pain Research and Therapy, vol. 21, Raven Press, New York; 1995.
- ↑ Sessle BJ, Bryant PS, Dionne RA. Temporomandibular Disorders and Related Pain Conditions, Progress in Pain Research and Management, vol. 4, IASP Press, Seattle, WA, 1995.
- ↑ 5,0 5,1 Svensson P, Graven-Nielsen T. Craniofacial muscle pain: review of mechanisms and clinical manifestations. J Orofacial Pain 2001; 15: 117-145.
- ↑ 6,0 6,1 6,2 6,3 Lund JP, Donga R, Widmer CG, Stohler CS. The pain-adaptation model: a discussion of the relationship between chronic musculoskeletal pain and motor activity. Can J Physiol Pharmacol 1991; 69: 683-694.
- ↑ 7,0 7,1 Cruccu G, Frisardi G, Pauletti G, Romaniello A, Manfredi M. Excitability of the central masticatory pathways in patients with painful temporomandibular disorders. Pain 1997; 73: 447-454.
- ↑ 8,0 8,1 Svensson P, Arendt-Nielsen L. Clinical and experimental aspects of temporomandibular disorders. Curr Rev Pain 2000; 4: 158-165.
- ↑ 9,0 9,1 Maixner W, Fillingim R, Booker D, Sigurdsson A. ```it Sensibilità dei pazienti con disturbi temporomandibolari dolorosi al dolore evocato sperimentalmente. Pain 1995; 63: 341-351.
- ↑ 10,0 10,1 Maixner W, Fillingim R, Sigurdsson A, Kincaid S, Silva S. Sensibilità dei pazienti con disturbi temporomandibolari dolorosi al dolore evocato sperimentalmente: evidenza di una sommatoria temporale alterata del dolore. Pain 1998; 76: 71-81.
- ↑ 11,0 11,1 Romaniello A, Arendt-Nielsen L, Cruccu G, Svensson P. Modulazione dei potenziali evocati dal laser trigeminale e dei periodi silenti del laser mediante dolore sperimentale omotopico. Pain, submitted.
- ↑ Bromm B, Treede RD. Potenziali cerebrali evocati dal laser nella valutazione della sensibilità al dolore cutaneo in soggetti normali e pazienti. Rev Neurol (Paris) 1991; 147: 625-643.
- ↑ Cruccu G, Romaniello A, Amantini A, Lombardi M, Innocenti P, Manfredi M. Valutazione della funzione delle piccole fibre trigeminali: risposte cerebrali e riflesse evocate dalla stimolazione laser CO2. Muscle Nerve 1999; 22: 508-516.
- ↑ Magerl W, Ali Z, Ellrich J, Meyer RA, Treede RD. Componenti delle fibre C e A delta dei potenziali cerebrali evocati dal calore in soggetti umani sani. Pain 1999; 82: 127-137.
- ↑ Cruccu G, Agostino R, Lahuerta J, Manfredi M. Inhibition of jaw-closing muscles by electrical stimulation of the ophthalmic division in man. Brain Res 1986; 371: 298-304.
- ↑ Ongerboer de Visser BW, Cruccu G. Neurophysiologic examination of the trigeminal, facial, hypoglossal, and spinal accessory nerves in cranial neuropathies and brain stem disorders. In: Brown WF, Bolton CF (eds). Clinical electromyography. Butterworth-Heinemann, Boston, 1993: 61-92.
- ↑ Coger RW, Kenton B, Pinsky JJ, Crue BL, Carmon A, Friedman Y. Potenziali evocati somatosensoriali e stimolazione nociva in pazienti con sindromi dolorose intrattabili non oncologiche. Psychiatry Res 1980; 2: 279-294.
- ↑ Gibson SJ, LeVasseur SA, Helme RD. Risposte cerebrali evento-correlate indotte da stimolazione laser a CO2 in soggetti affetti da sindrome cervico-brachiale. Pain 1991; 47: 173-182.
- ↑ Casey KL, Beydoun A, Boivie J, Sjolund B, Holmgren H, Leijon G, Morrow TJ, Rosen I. Potenziali cerebrali evocati dal laser e funzione sensoriale in pazienti con dolore centrale. Pain 1996; 64: 485-491.
- ↑ Svensson P, Bjerring P, Arendt-Nielsen L, Kaaber S. Soglie sensoriali e del dolore alla stimolazione laser con argon orofacciale in pazienti con sindrome della bocca urente cronica. Clin J Pain 1993; 9:207-215.
- ↑ Gracely RH. Quantificazione soggettiva della percezione del dolore. In: Bromm B (ed.), Pain Measurement in Man: Neurophysiological Correlates of Pain, Elsevier, Amsterdam, 1984: 111-137.
- ↑ Langermark M, Jensen K, Jensen TS, Olesen J. Soglie del dolore da pressione e soglie nocicettive termiche nella cefalea tensiva cronica. Pain 1989; 38: 203-210.
- ↑ Hazouri LA, Mueller AD. Studi sulla soglia del dolore in pazienti paraplegici. Arch Neurol Psychiatry 1950; 64: 607-613.
- ↑ Callaghan M, Sternbach RA, Nyquist JK, Timmermans G. Changes in somatic sensitivity during transcutaneous electrical analgesia. Pain 1978; 5:115-127.
- ↑ Naliboff BD, Cohen MJ, Schandler SL, Heinrich RL. Signal detection and threshold measures for chronic low back pain patients, chronic illness, and cohort controls to radiant heat stimuli. J Abnorm Psychol 1981; 90: 271-274.
- ↑ Cohen MJ, Naliboff BD, Schandler SL, Heinrich RL. Signal detection and threshold measures to loud tones and radiant heat in chronic low back pain patients and cohort controls. Pain 1983; 16: 245-252.
- ↑ Quimby LG, Block SR, Gratwick GM. Fibromyalgia: generalized pain intolerance and manifold symptom reporting. J Rheumatol 1988; 15: 1264-1270.
- ↑ Scudd RA, Rollman GB, Harth M, McCain GA. Pain perception and personality measures as discriminators in the classification of fibrositis. J Rheumatol 1987; 14: 563-569.
- ↑ Merskey H. The effect of chronic pain upon response to noxious stimuli by psychiatric patients. J Psychosom Res 1964; 8: 405-419.
- ↑ Merskey H, Evans PR. Variations in pain complaint threshold in psychiatric and neurological patients with pain. Pain 1975; 1: 73-79.
- ↑ Stohler CS. Craniofacial Pain and Motor Function, Exp Brain Res 1995; 99: 46-53.
- ↑ Svensson P, Arendt-Nielsen L, Bjerring P, Bak P, Hjorth T, Troest T. Human mastication modulated by experimental trigeminal and extra-trigeminal painful stimuli. J Oral Rehabil 1996a; 23: 838-848.
- ↑ Svensson P, Arendt-Nielsen L, Houe L. Sensory-motor interactions of human experimental unilateral jaw muscle pain: a quantitative analysis. Pain 1996b; 64: 241-249.
- ↑ 34,0 34,1 Miles TS, Turker KS. Does reflex inhibition of motor units follow the "size principle"? Exp Brain Res 1986; 62: 443-445.
- ↑ Ellrich J, Hopf HC, Treede RD. Nociceptive masseter inhibitory reflexes evoked by laser radiant heat and electrical stimuli. Brain Res 1997; 764: 214-220.
- ↑ 36,0 36,1 Cruccu G, Romaniello A. Jaw-opening reflex after CO2 laser stimulation of the perioral region in man. Exp Brain Res 1998; 118: 564-568.
- ↑ Sessle BJ. Neural mechanisms and pathways in craniofacial pain. Can J Neurol Sci 1999; 26: 7-11.
- ↑ Wang K, Svensson P, Arendt-Nielsen L. Modulation of exteroceptive suppression periods in human jaw-closing muscles by local and remote experimental muscle pain. Pain 1999; 82: 253-262.
- ↑ Bendtsen L, Jensen R, Brennum J, Arendt-Nielsen L, Olesen J. Exteroceptive suppression periods in jaw-closing muscles. Variability and relation to experimental pain and sustained muscle contraction. Cephalalgia 1993; 13: 184-191.
- ↑ Bendtsen L, Jensen R, Brennum J, Arendt-Nielsen L, Olesen J. Exteroceptive suppression of temporal muscle activity is normal in chronic tension-type headache and not related to actual headache state. Cephalalgia 1996; 16: 251-256.
- ↑ Cadden SW, Newton JP. The effects of inhibitory controls triggered by heterotopic noxious stimuli on a jaw reflex evoked by perioral stimuli in man. Arch Oral Biol 1994; 39: 473-480.
- ↑ Schoenen J, Wang W, Gerard P. Modulation of temporalis muscle exteroceptive suppression by limb stimuli in normal man. Brain Res 1994; 657: 214-220.
- ↑ De Laat A, Svensson P, Macaluso GM. Are jaw and facial reflexes modulated during clinical or experimental orofacial pain? J Orofac Pain 1998; 12: 260-271.
- ↑ Schoenen J. Exteroceptive suppression of temporalis muscle activity: Methodological aspects and pathophysiological implications. Cephalalgia 1993; 13: 82-91.
- ↑ Darian-Smith I. Presynaptic component in the afferent inhibition observed within trigeminal brain-stem nuclei of the cat. J Neurophysiol 1965; 28: 695-709.
- ↑ Hu JW, Sessle BJ. Properties of functionally identified nociceptive and nonnociceptive facial primary afferents and presynaptic excitability changes induced in their brain stem endings by raphe and orofacial stimuli in cats. Exp Neurol 1988; 101: 385-399.
- ↑ Fitzgerald M. The contralateral input to the dorsal horn of the spinal cord in the decerebrate spinal rat. Brain Res 1982; 236: 257-287.