Ruolo dei Recettori Glutammatergici Metabotropici nel Dolore: differenze tra le versioni
Creata pagina con "{{main menu it |link to German= Hauptseite |link to Spanish= Pàgina Principal |link to French= Page d'accueil |link to Italian= Introduzione |link to English= Introduction }} <div class="chapter-content"> {{ArtBy|||autore=Silvia Natoli|autore2=Cesare Iani|autore3=Massimo Tolu|autore4=Antonio Pisani}} ==Glutamic Acid as a Key Excitatory Neurotransmitter== Glutamic acid represents the most widespread excitatory neurotransmitter in the Central Nervous System (CNS) and..." |
Nessun oggetto della modifica |
||
| Riga 10: | Riga 10: | ||
== | ==L'acido Glutammico come Principale Neurotrasmettitore Eccitatorio== | ||
L'acido glutammico rappresenta il neurotrasmettitore eccitatorio più diffuso nel Sistema Nervoso Centrale (SNC) e svolge un ruolo chiave in molteplici funzioni. Negli ultimi anni, la scoperta dei recettori metabotropici del glutammato, una classe di recettori accoppiati a proteine G, ha portato a una sostanziale mole di lavoro sperimentale volto a chiarire il ruolo di questi recettori sia nelle attività fisiologiche che nei processi patologici all'interno del SNC <ref>Conn PJ, Pin JP. Pharmacology and functions of metabotropic glutamate receptors. Annu Rev Pharmacol Toxicol. 1997;37:205-37.</ref>. I recettori dell'acido glutammico sono divisi in due principali categorie funzionali: ionotropici e metabotropici (mGlu) <ref>Conn PJ, Pin JP. Pharmacology and functions of metabotropic glutamate receptors. Annu Rev Pharmacol Toxicol. 1997;37:205-37.</ref>. | |||
[[File:Pisani 1.jpg|thumb|''' | [[File:Pisani 1.jpg|thumb|'''Figura 1:''' Struttura generale dei recettori mGlu per il glutammato.<nowiki>'''</nowiki> La struttura mostra sette domini transmembrana, il residuo ammino-terminale (NH2) e il residuo carbossi-terminale (COOH).]] | ||
Il gruppo dei recettori metabotropici, che include otto recettori, è ulteriormente suddiviso in tre sottogruppi basati sull'omologia della sequenza amminoacidica, sui profili farmacologici e sui meccanismi di trasduzione del segnale post-recettore (Fig. 1). Il Gruppo I include i recettori mGlu1 e mGlu5, attivati da agonisti specifici per questi recettori (DHPG e CHPG). L'attivazione dei recettori del Gruppo I stimola l'idrolisi dei fosfoinositidi di membrana attraverso un meccanismo dipendente dalla proteina G. Il Gruppo II (mGlu2, mGlu3) e il Gruppo III (mGlu4, mGlu6, mGlu7, mGlu8), attivati rispettivamente dagli agonisti selettivi LY379268 e L-SOP, condividono il meccanismo di riduzione della sintesi di cAMP <ref>Conn PJ, Pin JP. Pharmacology and functions of metabotropic glutamate receptors. Annu Rev Pharmacol Toxicol. 1997;37:205-37.</ref>. | |||
mGlu | I recettori mGlu regolano l'eccitabilità neuronale in varie regioni del SNC, principalmente modulando l'attivazione dei canali ionici. Questi recettori sono stati implicati nella patogenesi di diverse malattie del SNC, tra cui epilessia, ischemia e malattie neurodegenerative <ref>Conn PJ, Pin JP. Pharmacology and functions of metabotropic glutamate receptors. Annu Rev Pharmacol Toxicol. 1997;37:205-37.</ref>. | ||
Studi farmacologici, immunoistochimici e di ibridazione in situ recenti indicano che i recettori mGlu del Gruppo I svolgono un ruolo chiave nella trasmissione nocicettiva. Oltre al loro ruolo nella trasmissione del dolore a livello del SNC, sia a livello spinale che cortico-talamico, è stato dimostrato che il glutammato eccita anche i neuroni nocicettivi periferici, mediando risposte parzialmente correlate a | |||
l'attivazione dei recettori ionotropici e in parte all'attivazione dei recettori mGlu <ref>Conn PJ, Pin JP. Pharmacology and functions of metabotropic glutamate receptors. Annu Rev Pharmacol Toxicol. 1997;37:205-37.</ref>. | |||
Negli ultimi anni, la ricerca farmacologica è diventata più efficace grazie alla sintesi di nuove molecole più selettive per i singoli recettori. Pertanto, i recettori metabotropici del glutammato rappresentano un nuovo e promettente bersaglio per la terapia analgesica <ref>Conn PJ, Pin JP. Pharmacology and functions of metabotropic glutamate receptors. Annu Rev Pharmacol Toxicol. 1997;37:205-37.</ref>. | |||
---- | ---- | ||
== | == Ruolo dei Recettori mGlu del Gruppo I nei Meccanismi Neurofisiopatologici == | ||
Oltre a svolgere un ruolo essenziale in varie attività fisiologiche, il glutammato è stato implicato nella patogenesi di diverse condizioni patologiche che colpiscono il SNC. Questo è dovuto principalmente alla sua ampia distribuzione in tutte le aree cerebrali, ma anche alla sua capacità di attivare sottotipi di recettori collegati all'attivazione di canali ionici permeabili al calcio, il cui accumulo è noto per essere dannoso per i neuroni. Infatti, l'eccessiva stimolazione dei recettori del glutammato porta alla morte neuronale, un fenomeno denominato "eccitotossicità," che è stato proposto come meccanismo patogenetico per una varietà di disturbi del SNC, come l'ischemia cerebrale <ref>Rothman SM, Olney JW. Glutamate and the pathophysiology of hypoxic--ischemic brain damage. Ann Neurol. 1986 Feb;19(2):105-11.</ref>. Il concetto di eccitotossicità è stato esteso anche all'epilessia e ai disturbi neurodegenerativi cronici come il morbo di Parkinson, il morbo di Alzheimer e la corea di Huntington <ref>Albin RL, Greenamyre TJ. Alternative excitotoxic hypotheses. Neurology. 1992 Apr;42(4):733-8.</ref>. Il ruolo esatto del glutammato in questi fenomeni patologici non è ancora completamente compreso, se sia una causa sufficiente o un fattore contributivo alla morte neuronale. Tuttavia, evidenze sperimentali suggeriscono che gli antagonisti dei recettori del glutammato possono esercitare azioni neuroprotettive. | |||
I gangli della base, e in particolare lo striato, rappresentano una delle regioni cerebrali più vulnerabili agli insulti ischemici ed eccitotossici, che sono associati all'eccessiva attivazione dei recettori del glutammato. Le elevate richieste energetiche necessarie alle cellule neuronali sono essenziali per mantenere una corretta omeostasi ionica. All'interno dello striato, le cellule proiettive GABAergiche mostrano una vulnerabilità selettiva sia alla deprivazione energetica che al danno eccitotossico, mentre altri tipi di cellule, come gli interneuroni colinergici e gli interneuroni positivi alla sintasi dell'ossido nitrico, sono particolarmente resistenti <ref>Ferrante RJ, Kowall NW, Beal MF, Richardson EP Jr, Bird ED, Martin JB. Selective sparing of a class of striatal neurons in Huntington's disease. Science. 1985 Nov 1;230(4725):561-3.</ref>. Tuttavia, le ragioni di questa vulnerabilità differenziale rimangono poco chiare. | |||
Nei nostri laboratori, abbiamo sviluppato tecniche elettrofisiologiche e fluorimetriche per valutare le risposte neuronali | |||
a vari stimoli esogeni. In particolare, i ratti Wistar maschi vengono sacrificati e le sezioni coronali corticostriatali (200-300 μm) vengono tagliate con un vibratomo da blocchi di tessuto cerebrale. Una sezione viene trasferita in una camera di registrazione, dove viene immersa in una soluzione di Krebs (2-3 ml/min), gassata con una miscela di 95% O2 - 5% CO2, e mantenuta a una temperatura costante (32-33°C). Per le registrazioni elettrofisiologiche intracellulari, vengono utilizzati microelettrodi riempiti con KCl. Sia le registrazioni in current-clamp che in voltage-clamp vengono effettuate utilizzando un amplificatore Axoclamp-2A. Per le registrazioni fluorimetriche ed elettriche simultanee, il microelettrodo è riempito con una soluzione di 1 mM bis-fura2 o 5 mM SBFI in 100 mM KCl per le misurazioni del calcio o del sodio, rispettivamente. La camera di registrazione è montata su un microscopio (Zeiss) dotato di un obiettivo 60X (Olympus). L'epilluminazione è fornita da una lampada allo Xenon da 75W, filtrata alternativamente a 340 e 380 nm. La luce di emissione è filtrata a 500 nm, rilevata da una telecamera CCD, e le immagini sono analizzate utilizzando il software Ionvision (ImproVision, UK). | |||
È stato dimostrato che i neuroni spinosi e gli interneuroni colinergici mostrano diverse sensibilità agli agonisti glutamatergici, sia ionotropici che metabotropici <ref>Calabresi P, Centonze D, Pisani A, Sancesario G, Gubellini P, Marfia GA, Bernardi G. Striatal spiny neurons and cholinergic interneurons express differential ionotropic glutamatergic responses and vulnerability: implications for ischemia and Huntington's disease. Ann Neurol. 1998 May;43(5):586-97.</ref>. Queste cellule rispondono in modi opposti alla deprivazione energetica <ref>Calabresi P, Saiardi A, Pisani A, Baik JH, Centonze D, Mercuri NB, Bernardi G, Borrelli E. Abnormal synaptic plasticity in the striatum of mice lacking dopamine D2 receptors. J Neurosci. 1997 Jun 15;17(12):4536-44.</ref>, dimostrando un substrato funzionale, ovvero la sensibilità dei recettori glutamatergici tra neuroni spinosi e interneuroni, capace di determinare comportamenti opposti tra i tipi cellulari. Inoltre, l'interazione funzionale tra i recettori ionotropici e mGlu appare significativamente diversa ed è certamente uno dei possibili co-fattori responsabili delle diverse vulnerabilità neuronali striatali. | |||
[[File:Pisani 2.jpg|thumb|400x400px|Figura 2: La registrazione elettrofisiologica da un neurone spinoso nello striato<nowiki>'''</nowiki> mostra la depolarizzazione della membrana indotta dall'applicazione di NMDA. La linea tratteggiata indica l'incubazione con 3,5-DHPG, un agonista del gruppo 1 mGlu. Dopo l'incubazione, la risposta NMDA è significativamente potenziata (traccia a destra).]] | |||
Infatti, è stato osservato che mentre le risposte del recettore NMDA nei neuroni spinosi striatali sono significativamente potenziate dagli agonisti del Gruppo I mGlu (Fig. 2) <ref>Pisani A, Gubellini P, Bonsi P, Conquet F, Picconi B, Centonze D, Bernardi G, Calabresi P. Metabotropic glutamate receptor 5 mediates the potentiation of N-methyl-D-aspartate responses in medium spiny striatal neurons. Neuroscience. | |||
<ref>2001;106(3):579-87.</ref>, questa potenziamento non è mai osservato nei neuroni interneuroni colinergici <ref>Calabresi P, Centonze D, Pisani A, Bernardi G. Metabotropic glutamate receptors and cell-type-specific vulnerability in the striatum: implication for ischemia and Huntington's disease. Exp Neurol. 1999 Jul;158(1):97-108.</ref>. | |||
Lo sviluppo di agenti farmacologici selettivi per i recettori ionotropici è stato recentemente ostacolato dall'emergere di effetti avversi significativi nelle fasi avanzate delle sperimentazioni cliniche. Al contrario, ci sono stati notevoli progressi nello sviluppo di agonisti e antagonisti selettivi per i recettori mGlu. Sviluppando farmaci che possono inibire selettivamente la trasmissione glutamatergica mediata dai recettori mGlu, potrebbe essere possibile evitare l'insorgenza di effetti collaterali associati all'attivazione dei recettori ionotropici. In particolare, lo sforzo più promettente negli ultimi 5-10 anni è stato la creazione di antagonisti dei recettori per il Gruppo I dei recettori mGlu, specificamente mGlu1 e mGlu5. | |||
==Ruolo dei Recettori mGlu del Gruppo I nella Trasmissione del Dolore Centrale== | |||
Le evidenze sperimentali suggeriscono un coinvolgimento significativo degli aminoacidi eccitatori, glutammato e aspartato, nella mediazione della trasmissione nocicettiva sia acuta che cronica <ref>Dickenson AH, Chapman V, Green GM. The pharmacology of excitatory and inhibitory amino acid-mediated events in the transmission and modulation of pain in the spinal cord. Gen Pharmacol. 1997 May;28(5):633-8.</ref>. Infatti, un gran numero di fibre sensoriali periferiche contengono glutammato, incluse le fibre C, e circa l'80% delle fibre di Sostanza P <ref>Battaglia G, Rustioni A. Coexistence of glutamate and substance P in dorsal root ganglion neurons of the rat and monkey. J Comp Neurol. 1988 Nov 8;277(2):302-12.</ref>. Nel midollo spinale, la risposta a stimoli meccanici o termici acuti e brevi coinvolge principalmente i recettori ionotropici di tipo AMPA. Se lo stimolo è prolungato o se la frequenza o l'intensità dello stimolo è aumentata, vengono attivati anche i recettori ionotropici di tipo NMDA. Questo fenomeno risulta in un potenziamento della risposta sensoriale, un meccanismo noto come "sensibilizzazione". La sensibilizzazione è una risposta aumentata a uno stimolo ed è stata riprodotta sperimentalmente in preparazioni del midollo spinale utilizzando il paradigma sperimentale noto come "wind-up" <ref>Woolf CJ. Evidence for a central component of post-injury pain hypersensitivity. Nature. 1983 Dec 15-21;306(5944):686-8.</ref>. | |||
Il fenomeno del "wind-up" è un aumento del numero di potenziali d'azione generati da un neurone dopo stimoli successivi durante una serie di impulsi. È stato proposto che il "wind-up" rappresenti un meccanismo centrale di iperalgesia. È interessante notare che sia il glutammato che l'agonista ionotropico esogeno NMDA riproducono il fenomeno, mentre gli antagonisti dei recettori NMDA sono in grado di prevenirlo. Studi recenti suggeriscono il coinvolgimento dei recettori mGlu nella trasmissione nocicettiva in linea con la loro distribuzione anatomica, | |||
che mostra la presenza di recettori del Gruppo I (mGlu1 e mGlu5) nelle lamine I e II delle colonne dorsali <ref>Valerio A, Rizzonelli P, Paterlini M, Moretto G, Knopfel T, Kuhn R, Memo M, Spano P. Distribuzione del recettore metabotropico del glutammato mGluR5 nel midollo spinale di ratto e umano: uno studio sullo sviluppo. Neurosci Res. 1997 May;28(1):49-57.</ref>. Simile a quanto osservato con gli antagonisti del recettore NMDA, è stato dimostrato che gli antagonisti del Gruppo I mGlu sono efficaci nell'inibire il wind-up <ref>Boxall SJ, Berthele A, Laurie DJ, Sommer B, Zieglgansberger W, Urban L, Tolle TR. L'attivazione del recettore metabotropico del glutammato contribuisce all'attività riflessa nocicettiva nel midollo spinale del ratto in vitro. Neuroscience. 1996 Sep;74(1):13-20.</ref>. | |||
Questo è confermato da evidenze sperimentali che gli agonisti mGlu inducono il fenomeno essi stessi. Uno dei paradigmi sperimentali utilizzati per studiare la risposta a stimoli nocicettivi acuti in vitro prevede una singola stimolazione elettrica robusta delle radici dorsali sufficiente a reclutare sia le fibre A che C. È stato dimostrato che gli antagonisti del Gruppo I mGlu, ma non gli antagonisti NMDA, sono in grado di bloccare la componente tardiva dei potenziali registrati dalle radici ventrali <ref>Boxall SJ, Berthele A, Laurie DJ, Sommer B, Zieglgansberger W, Urban L, Tolle TR. L'attivazione del recettore metabotropico del glutammato contribuisce all'attività riflessa nocicettiva nel midollo spinale del ratto in vitro. Neuroscience. 1996 Sep;74(1):13-20.</ref>. La fase tardiva, spesso attribuita all'attivazione delle fibre C, è definita "peptidergica" perché viene bloccata dagli antagonisti del recettore della neurochinina. La componente precoce del potenziale è principalmente mediata dai recettori ionotropici di tipo AMPA e non viene bloccata dagli antagonisti mGlu. | |||
L'attivazione dei neuroni del corno dorsale è prodotta anche dall'applicazione di olio di senape, un irritante chimico capace di attivare le fibre C. L'olio di senape induce la sensibilizzazione centrale di questi neuroni agli stimoli nocicettivi afferenti, un processo in molti modi analogo al wind-up. Questa sensibilizzazione è prevenuta dal pretrattamento con antagonisti del Gruppo I, confermando l'ipotesi del coinvolgimento del Gruppo I mGlu nel dolore infiammatorio. Insieme, questi risultati suggeriscono che, oltre al ruolo dei recettori NMDA, i recettori del Gruppo I mGlu sono essenziali nella generazione della risposta nocicettiva a livello del midollo spinale. | |||
Il talamo rappresenta una stazione di rilancio critica per le informazioni nocicettive. Uno dei modelli sperimentali utilizzati per analizzare gli effetti farmacologici a livello talamico prevede la stimolazione delle vibrisse dell'animale. È stato osservato che le risposte dei neuroni talamici a stimoli termici dolorosi sono ridotte dagli antagonisti del Gruppo I mGlu. È importante notare che l'effetto è selettivo, nel senso che se lo stimolo non induce una sensazione dolorosa, non viene bloccato <ref>Eaton SA, Jane DE, Jones PL, Porter RH, Pook PC, Sunter DC, Udvarhelyi PM, Roberts PJ, Salt TE, Watkins JC. Antagonismo competitivo ai recettori metabotropici del glutammato</ref>. | |||
recettori da (S)-4-carbossifenilglicina e (RS)-alfa-metil-4-carbossifenilglicina. Eur J Pharmacol. 1993 Jan 15;244(2):195-7.</ref>. Uno studio più recente ha confermato questi risultati utilizzando un antagonista selettivo mGlu1, dimostrando per la prima volta un coinvolgimento diretto di un sottotipo specifico di recettore mGlu nella risposta nocicettiva a livello talamico <ref>Salt T, Turner JP. Reduction of sensory and metabotropic glutamate receptor responses in the thalamus by the novel metabotropic glutamate receptor-1-selective antagonist S-2-methyl-4-carboxy-phenylglycine. Neuroscience. 1998 Aug;85(3):655-8.</ref>. Questo risultato è coerente con la distribuzione dei recettori mGlu1 nel talamo. | |||
Simile al talamo, a livello della corteccia somatosensoriale, la stimolazione sensoriale delle vibrisse non è alterata dagli antagonisti del Gruppo I mGlu, suggerendo che questi recettori non sono coinvolti nella trasmissione di stimoli meccanici semplici. Al contrario, la stimolazione dolorosa è bloccata dagli antagonisti del Gruppo I mGlu. Studi comportamentali utilizzando il modello "hot-plate" per studiare i riflessi nocicettivi hanno mostrato che l'iniezione intraventricolare di antagonisti del Gruppo I riduce significativamente le risposte nocicettive <ref>Moroni F, Lombardi G, Thomsen C, Leonardi P, Attucci S, Peruginelli F, Torregrossa SA, Pellegrini-Giampietro DE, Luneia R, Pellicciari R. Pharmacological characterization of 1-aminoindan-1,5-dicarboxylic acid, a potent mGluR1 antagonist. J Pharmacol Exp Ther. 1997 May;281(2):721-9.</ref>. | |||
Il ruolo della sostanza grigia periacqueduttale (PAG) nella trasmissione nocicettiva non è completamente compreso. Tuttavia, evidenze sperimentali indicano che l'attivazione dei recettori mGlu del Gruppo I nella PAG potenzia l'attività antinocicettiva della via discendente che origina da quest'area cerebrale. Infatti, studi recenti indicano che la somministrazione intra-PAG di DHPG, un agonista del Gruppo I mGlu, riduce l'iperalgesia indotta da iniezioni di formalina <ref>Maione S, Oliva P, Marabese I, Palazzo E, Rossi F, Berrino L, Filippelli A. Periaqueductal gray matter metabotropic glutamate receptors modulate formalin-induced nociception. Pain. 2000 Mar;85(1-2):183-9.</ref>. Si pensa che questo effetto sia legato alla capacità del glutammato, attraverso l'attivazione mGlu, di prevenire l'instaurarsi del fenomeno del wind-up. | |||
== Ruolo dei Recettori mGlu nei Meccanismi di Trasmissione Nocicettiva Periferica == | |||
Il ruolo del glutammato nel Sistema Nervoso Periferico è ancora poco chiaro. È stato dimostrato che l'iniezione sottocutanea di glutammato nei ratti riduce la soglia di attivazione per stimoli meccanici e termici <ref>Jackson DL, Graff CB, Richardson JD, Hargreaves KM. Glutamate participates in the peripheral modulation of thermal hyperalgesia in rats. Eur J Pharmacol. 1995 Sep 25;284(3):321-5.</ref>. L'applicazione di antagonisti per i recettori ionotropici del glutammato attenua i livelli nocicettivi nel test della formalina, un modello utilizzato per studiare il dolore infiammatorio. Inoltre, la concentrazione di glutammato aumenta nel | |||
tessuto cutaneo dopo la stimolazione del nervo sciatico e durante il test della formalina nei ratti <ref>de Groet M, van der Kooy D. Sensory neuron specific receptor activation reduces pain in rats. Nature. 2000.</ref>. Complessivamente, questi dati suggeriscono che il glutammato agisce come un mediatore efficace dell'infiammazione periferica a seguito di lesioni tissutali e che il glutammato periferico attiva i recettori ionotropici. | |||
Lo studio dei ruoli dei recettori mGlu nella trasmissione del dolore era, fino a pochi anni fa, confinato alle colonne dorsali del midollo spinale. Studi neurofisiologici hanno dimostrato che i recettori del Gruppo I sono coinvolti nell'iper-eccitabilità di questi neuroni a seguito di stimoli infiammatori. Studi comportamentali indicano che l'iniezione intratecale di agonisti del Gruppo I induce iperalgesia; inoltre, la somministrazione intratecale di antagonisti dei recettori mGlu del Gruppo I riduce l'infiammazione e il dolore neuropatico <ref>Fisher K, Coderre TJ. Hyperalgesia and allodynia induced by intrathecal (RS)-dihydroxyphenylglycine in rats. Neuroreport. 1998 Apr 20;9(6):1169-72.</ref><ref>Fisher K, Fundytus ME, Cahill CM, Coderre TJ. Intrathecal administration of the mGluR compound, (S)-4CPG, attenuates hyperalgesia and allodynia associated with sciatic nerve constriction injury in rats.</ref>. Coerentemente con questi studi, la ricerca immunocitochimica ha localizzato i recettori mGlu del Gruppo I nei corni dorsali del midollo spinale. Questi studi confermano l'ipotesi che i recettori mGlu siano importanti nella sensibilizzazione spinale a seguito di lesioni tissutali. | |||
Più recentemente, è stata dimostrata la presenza di mRNA per il recettore mGlu5 del Gruppo I nei gangli delle radici dorsali di ratti adulti e neonatali. Questo risultato suggerisce la possibilità che, oltre a un ruolo come mediatore dell'infiammazione periferica, il glutammato possa mediare l'attività afferente primaria dalla periferia attraverso l'attivazione dei recettori mGlu5 <ref>Bhave G, Karim F, Carlton SM, Gereau RW. Peripheral group I metabotropic glutamate receptors modulate nociception in mice. Nat Neurosci. 2001 Apr;4(4):417-23.</ref>. In questo studio, gli autori hanno investigato il ruolo dei recettori mGlu periferici nel dolore infiammatorio e nella nocicezione termica, dimostrando che sia i recettori mGlu1 che mGlu5 sono espressi nelle fibre afferenti nocicettive non mielinizzate. Inoltre, l'iniezione periferica di agonisti per questi recettori è stata in grado di indurre iperalgesia attraverso l'attivazione sia di mGlu1 che di mGlu5. Infine, gli antagonisti di questi recettori hanno bloccato l'iperalgesia indotta dal glutammato e ridotto significativamente il dolore infiammatorio nel test della formalina <ref>Bhave G, Karim F, Carlton SM, Gereau RW. Peripheral group I metabotropic glutamate receptors modulate nociception in mice. Nat Neurosci. 2001 Apr;4(4):417-23.</ref>. | |||
Questi risultati suggeriscono che i recettori mGlu del Gruppo I mediano, almeno in parte, la trasmissione nocicettiva e quindi possono rappresentare un interessante bersaglio terapeutico. | |||
==Conclusioni== | |||
Comprendere le funzioni dei recettori mGlu nel Sistema Nervoso Centrale e Periferico | |||
I Sistemi Nervosi hanno fatto progressi significativi negli ultimi anni. In particolare, il ruolo dei recettori mGlu del Gruppo I (mGlu1 e mGlu5) è stato ampiamente studiato a livello molecolare, cellulare e comportamentale, evidenziando la loro importanza in numerose funzioni fisiologiche e processi patologici. Sia mGlu1 che mGlu5 sono stati implicati in una varietà di disturbi cerebrali, tra cui epilessia, dolore, ischemia e malattie neurodegenerative. Il potenziale di questi recettori di modulare la trasmissione glutamatergica e la loro presenza in diverse aree del cervello potrebbe, quindi, rappresentare un vero obiettivo per il trattamento dei disturbi neurologici. | |||
{{Bib}} | {{Bib}} | ||
Versione attuale delle 00:18, 3 mag 2025
Ruolo dei Recettori Glutammatergici Metabotropici nel Dolore
L'acido Glutammico come Principale Neurotrasmettitore Eccitatorio modifica modifica sorgente
L'acido glutammico rappresenta il neurotrasmettitore eccitatorio più diffuso nel Sistema Nervoso Centrale (SNC) e svolge un ruolo chiave in molteplici funzioni. Negli ultimi anni, la scoperta dei recettori metabotropici del glutammato, una classe di recettori accoppiati a proteine G, ha portato a una sostanziale mole di lavoro sperimentale volto a chiarire il ruolo di questi recettori sia nelle attività fisiologiche che nei processi patologici all'interno del SNC [1]. I recettori dell'acido glutammico sono divisi in due principali categorie funzionali: ionotropici e metabotropici (mGlu) [2].
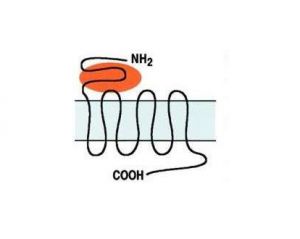
Il gruppo dei recettori metabotropici, che include otto recettori, è ulteriormente suddiviso in tre sottogruppi basati sull'omologia della sequenza amminoacidica, sui profili farmacologici e sui meccanismi di trasduzione del segnale post-recettore (Fig. 1). Il Gruppo I include i recettori mGlu1 e mGlu5, attivati da agonisti specifici per questi recettori (DHPG e CHPG). L'attivazione dei recettori del Gruppo I stimola l'idrolisi dei fosfoinositidi di membrana attraverso un meccanismo dipendente dalla proteina G. Il Gruppo II (mGlu2, mGlu3) e il Gruppo III (mGlu4, mGlu6, mGlu7, mGlu8), attivati rispettivamente dagli agonisti selettivi LY379268 e L-SOP, condividono il meccanismo di riduzione della sintesi di cAMP [3].
I recettori mGlu regolano l'eccitabilità neuronale in varie regioni del SNC, principalmente modulando l'attivazione dei canali ionici. Questi recettori sono stati implicati nella patogenesi di diverse malattie del SNC, tra cui epilessia, ischemia e malattie neurodegenerative [4].
Studi farmacologici, immunoistochimici e di ibridazione in situ recenti indicano che i recettori mGlu del Gruppo I svolgono un ruolo chiave nella trasmissione nocicettiva. Oltre al loro ruolo nella trasmissione del dolore a livello del SNC, sia a livello spinale che cortico-talamico, è stato dimostrato che il glutammato eccita anche i neuroni nocicettivi periferici, mediando risposte parzialmente correlate a
l'attivazione dei recettori ionotropici e in parte all'attivazione dei recettori mGlu [5].
Negli ultimi anni, la ricerca farmacologica è diventata più efficace grazie alla sintesi di nuove molecole più selettive per i singoli recettori. Pertanto, i recettori metabotropici del glutammato rappresentano un nuovo e promettente bersaglio per la terapia analgesica [6].
Ruolo dei Recettori mGlu del Gruppo I nei Meccanismi Neurofisiopatologici modifica modifica sorgente
Oltre a svolgere un ruolo essenziale in varie attività fisiologiche, il glutammato è stato implicato nella patogenesi di diverse condizioni patologiche che colpiscono il SNC. Questo è dovuto principalmente alla sua ampia distribuzione in tutte le aree cerebrali, ma anche alla sua capacità di attivare sottotipi di recettori collegati all'attivazione di canali ionici permeabili al calcio, il cui accumulo è noto per essere dannoso per i neuroni. Infatti, l'eccessiva stimolazione dei recettori del glutammato porta alla morte neuronale, un fenomeno denominato "eccitotossicità," che è stato proposto come meccanismo patogenetico per una varietà di disturbi del SNC, come l'ischemia cerebrale [7]. Il concetto di eccitotossicità è stato esteso anche all'epilessia e ai disturbi neurodegenerativi cronici come il morbo di Parkinson, il morbo di Alzheimer e la corea di Huntington [8]. Il ruolo esatto del glutammato in questi fenomeni patologici non è ancora completamente compreso, se sia una causa sufficiente o un fattore contributivo alla morte neuronale. Tuttavia, evidenze sperimentali suggeriscono che gli antagonisti dei recettori del glutammato possono esercitare azioni neuroprotettive.
I gangli della base, e in particolare lo striato, rappresentano una delle regioni cerebrali più vulnerabili agli insulti ischemici ed eccitotossici, che sono associati all'eccessiva attivazione dei recettori del glutammato. Le elevate richieste energetiche necessarie alle cellule neuronali sono essenziali per mantenere una corretta omeostasi ionica. All'interno dello striato, le cellule proiettive GABAergiche mostrano una vulnerabilità selettiva sia alla deprivazione energetica che al danno eccitotossico, mentre altri tipi di cellule, come gli interneuroni colinergici e gli interneuroni positivi alla sintasi dell'ossido nitrico, sono particolarmente resistenti [9]. Tuttavia, le ragioni di questa vulnerabilità differenziale rimangono poco chiare.
Nei nostri laboratori, abbiamo sviluppato tecniche elettrofisiologiche e fluorimetriche per valutare le risposte neuronali
a vari stimoli esogeni. In particolare, i ratti Wistar maschi vengono sacrificati e le sezioni coronali corticostriatali (200-300 μm) vengono tagliate con un vibratomo da blocchi di tessuto cerebrale. Una sezione viene trasferita in una camera di registrazione, dove viene immersa in una soluzione di Krebs (2-3 ml/min), gassata con una miscela di 95% O2 - 5% CO2, e mantenuta a una temperatura costante (32-33°C). Per le registrazioni elettrofisiologiche intracellulari, vengono utilizzati microelettrodi riempiti con KCl. Sia le registrazioni in current-clamp che in voltage-clamp vengono effettuate utilizzando un amplificatore Axoclamp-2A. Per le registrazioni fluorimetriche ed elettriche simultanee, il microelettrodo è riempito con una soluzione di 1 mM bis-fura2 o 5 mM SBFI in 100 mM KCl per le misurazioni del calcio o del sodio, rispettivamente. La camera di registrazione è montata su un microscopio (Zeiss) dotato di un obiettivo 60X (Olympus). L'epilluminazione è fornita da una lampada allo Xenon da 75W, filtrata alternativamente a 340 e 380 nm. La luce di emissione è filtrata a 500 nm, rilevata da una telecamera CCD, e le immagini sono analizzate utilizzando il software Ionvision (ImproVision, UK).
È stato dimostrato che i neuroni spinosi e gli interneuroni colinergici mostrano diverse sensibilità agli agonisti glutamatergici, sia ionotropici che metabotropici [10]. Queste cellule rispondono in modi opposti alla deprivazione energetica [11], dimostrando un substrato funzionale, ovvero la sensibilità dei recettori glutamatergici tra neuroni spinosi e interneuroni, capace di determinare comportamenti opposti tra i tipi cellulari. Inoltre, l'interazione funzionale tra i recettori ionotropici e mGlu appare significativamente diversa ed è certamente uno dei possibili co-fattori responsabili delle diverse vulnerabilità neuronali striatali.
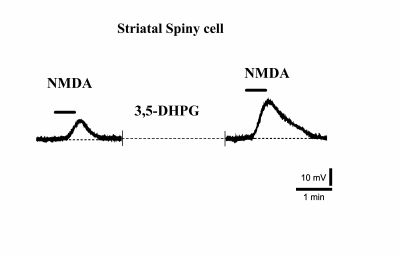
Infatti, è stato osservato che mentre le risposte del recettore NMDA nei neuroni spinosi striatali sono significativamente potenziate dagli agonisti del Gruppo I mGlu (Fig. 2) Errore nelle note: </ref> di chiusura mancante per il marcatore <ref>, questa potenziamento non è mai osservato nei neuroni interneuroni colinergici [12].
Lo sviluppo di agenti farmacologici selettivi per i recettori ionotropici è stato recentemente ostacolato dall'emergere di effetti avversi significativi nelle fasi avanzate delle sperimentazioni cliniche. Al contrario, ci sono stati notevoli progressi nello sviluppo di agonisti e antagonisti selettivi per i recettori mGlu. Sviluppando farmaci che possono inibire selettivamente la trasmissione glutamatergica mediata dai recettori mGlu, potrebbe essere possibile evitare l'insorgenza di effetti collaterali associati all'attivazione dei recettori ionotropici. In particolare, lo sforzo più promettente negli ultimi 5-10 anni è stato la creazione di antagonisti dei recettori per il Gruppo I dei recettori mGlu, specificamente mGlu1 e mGlu5.
Ruolo dei Recettori mGlu del Gruppo I nella Trasmissione del Dolore Centrale modifica modifica sorgente
Le evidenze sperimentali suggeriscono un coinvolgimento significativo degli aminoacidi eccitatori, glutammato e aspartato, nella mediazione della trasmissione nocicettiva sia acuta che cronica [13]. Infatti, un gran numero di fibre sensoriali periferiche contengono glutammato, incluse le fibre C, e circa l'80% delle fibre di Sostanza P [14]. Nel midollo spinale, la risposta a stimoli meccanici o termici acuti e brevi coinvolge principalmente i recettori ionotropici di tipo AMPA. Se lo stimolo è prolungato o se la frequenza o l'intensità dello stimolo è aumentata, vengono attivati anche i recettori ionotropici di tipo NMDA. Questo fenomeno risulta in un potenziamento della risposta sensoriale, un meccanismo noto come "sensibilizzazione". La sensibilizzazione è una risposta aumentata a uno stimolo ed è stata riprodotta sperimentalmente in preparazioni del midollo spinale utilizzando il paradigma sperimentale noto come "wind-up" [15].
Il fenomeno del "wind-up" è un aumento del numero di potenziali d'azione generati da un neurone dopo stimoli successivi durante una serie di impulsi. È stato proposto che il "wind-up" rappresenti un meccanismo centrale di iperalgesia. È interessante notare che sia il glutammato che l'agonista ionotropico esogeno NMDA riproducono il fenomeno, mentre gli antagonisti dei recettori NMDA sono in grado di prevenirlo. Studi recenti suggeriscono il coinvolgimento dei recettori mGlu nella trasmissione nocicettiva in linea con la loro distribuzione anatomica,
che mostra la presenza di recettori del Gruppo I (mGlu1 e mGlu5) nelle lamine I e II delle colonne dorsali [16]. Simile a quanto osservato con gli antagonisti del recettore NMDA, è stato dimostrato che gli antagonisti del Gruppo I mGlu sono efficaci nell'inibire il wind-up [17].
Questo è confermato da evidenze sperimentali che gli agonisti mGlu inducono il fenomeno essi stessi. Uno dei paradigmi sperimentali utilizzati per studiare la risposta a stimoli nocicettivi acuti in vitro prevede una singola stimolazione elettrica robusta delle radici dorsali sufficiente a reclutare sia le fibre A che C. È stato dimostrato che gli antagonisti del Gruppo I mGlu, ma non gli antagonisti NMDA, sono in grado di bloccare la componente tardiva dei potenziali registrati dalle radici ventrali [18]. La fase tardiva, spesso attribuita all'attivazione delle fibre C, è definita "peptidergica" perché viene bloccata dagli antagonisti del recettore della neurochinina. La componente precoce del potenziale è principalmente mediata dai recettori ionotropici di tipo AMPA e non viene bloccata dagli antagonisti mGlu.
L'attivazione dei neuroni del corno dorsale è prodotta anche dall'applicazione di olio di senape, un irritante chimico capace di attivare le fibre C. L'olio di senape induce la sensibilizzazione centrale di questi neuroni agli stimoli nocicettivi afferenti, un processo in molti modi analogo al wind-up. Questa sensibilizzazione è prevenuta dal pretrattamento con antagonisti del Gruppo I, confermando l'ipotesi del coinvolgimento del Gruppo I mGlu nel dolore infiammatorio. Insieme, questi risultati suggeriscono che, oltre al ruolo dei recettori NMDA, i recettori del Gruppo I mGlu sono essenziali nella generazione della risposta nocicettiva a livello del midollo spinale.
Il talamo rappresenta una stazione di rilancio critica per le informazioni nocicettive. Uno dei modelli sperimentali utilizzati per analizzare gli effetti farmacologici a livello talamico prevede la stimolazione delle vibrisse dell'animale. È stato osservato che le risposte dei neuroni talamici a stimoli termici dolorosi sono ridotte dagli antagonisti del Gruppo I mGlu. È importante notare che l'effetto è selettivo, nel senso che se lo stimolo non induce una sensazione dolorosa, non viene bloccato [19].
recettori da (S)-4-carbossifenilglicina e (RS)-alfa-metil-4-carbossifenilglicina. Eur J Pharmacol. 1993 Jan 15;244(2):195-7.</ref>. Uno studio più recente ha confermato questi risultati utilizzando un antagonista selettivo mGlu1, dimostrando per la prima volta un coinvolgimento diretto di un sottotipo specifico di recettore mGlu nella risposta nocicettiva a livello talamico [20]. Questo risultato è coerente con la distribuzione dei recettori mGlu1 nel talamo.
Simile al talamo, a livello della corteccia somatosensoriale, la stimolazione sensoriale delle vibrisse non è alterata dagli antagonisti del Gruppo I mGlu, suggerendo che questi recettori non sono coinvolti nella trasmissione di stimoli meccanici semplici. Al contrario, la stimolazione dolorosa è bloccata dagli antagonisti del Gruppo I mGlu. Studi comportamentali utilizzando il modello "hot-plate" per studiare i riflessi nocicettivi hanno mostrato che l'iniezione intraventricolare di antagonisti del Gruppo I riduce significativamente le risposte nocicettive [21].
Il ruolo della sostanza grigia periacqueduttale (PAG) nella trasmissione nocicettiva non è completamente compreso. Tuttavia, evidenze sperimentali indicano che l'attivazione dei recettori mGlu del Gruppo I nella PAG potenzia l'attività antinocicettiva della via discendente che origina da quest'area cerebrale. Infatti, studi recenti indicano che la somministrazione intra-PAG di DHPG, un agonista del Gruppo I mGlu, riduce l'iperalgesia indotta da iniezioni di formalina [22]. Si pensa che questo effetto sia legato alla capacità del glutammato, attraverso l'attivazione mGlu, di prevenire l'instaurarsi del fenomeno del wind-up.
Ruolo dei Recettori mGlu nei Meccanismi di Trasmissione Nocicettiva Periferica modifica modifica sorgente
Il ruolo del glutammato nel Sistema Nervoso Periferico è ancora poco chiaro. È stato dimostrato che l'iniezione sottocutanea di glutammato nei ratti riduce la soglia di attivazione per stimoli meccanici e termici [23]. L'applicazione di antagonisti per i recettori ionotropici del glutammato attenua i livelli nocicettivi nel test della formalina, un modello utilizzato per studiare il dolore infiammatorio. Inoltre, la concentrazione di glutammato aumenta nel
tessuto cutaneo dopo la stimolazione del nervo sciatico e durante il test della formalina nei ratti [24]. Complessivamente, questi dati suggeriscono che il glutammato agisce come un mediatore efficace dell'infiammazione periferica a seguito di lesioni tissutali e che il glutammato periferico attiva i recettori ionotropici.
Lo studio dei ruoli dei recettori mGlu nella trasmissione del dolore era, fino a pochi anni fa, confinato alle colonne dorsali del midollo spinale. Studi neurofisiologici hanno dimostrato che i recettori del Gruppo I sono coinvolti nell'iper-eccitabilità di questi neuroni a seguito di stimoli infiammatori. Studi comportamentali indicano che l'iniezione intratecale di agonisti del Gruppo I induce iperalgesia; inoltre, la somministrazione intratecale di antagonisti dei recettori mGlu del Gruppo I riduce l'infiammazione e il dolore neuropatico [25][26]. Coerentemente con questi studi, la ricerca immunocitochimica ha localizzato i recettori mGlu del Gruppo I nei corni dorsali del midollo spinale. Questi studi confermano l'ipotesi che i recettori mGlu siano importanti nella sensibilizzazione spinale a seguito di lesioni tissutali.
Più recentemente, è stata dimostrata la presenza di mRNA per il recettore mGlu5 del Gruppo I nei gangli delle radici dorsali di ratti adulti e neonatali. Questo risultato suggerisce la possibilità che, oltre a un ruolo come mediatore dell'infiammazione periferica, il glutammato possa mediare l'attività afferente primaria dalla periferia attraverso l'attivazione dei recettori mGlu5 [27]. In questo studio, gli autori hanno investigato il ruolo dei recettori mGlu periferici nel dolore infiammatorio e nella nocicezione termica, dimostrando che sia i recettori mGlu1 che mGlu5 sono espressi nelle fibre afferenti nocicettive non mielinizzate. Inoltre, l'iniezione periferica di agonisti per questi recettori è stata in grado di indurre iperalgesia attraverso l'attivazione sia di mGlu1 che di mGlu5. Infine, gli antagonisti di questi recettori hanno bloccato l'iperalgesia indotta dal glutammato e ridotto significativamente il dolore infiammatorio nel test della formalina [28].
Questi risultati suggeriscono che i recettori mGlu del Gruppo I mediano, almeno in parte, la trasmissione nocicettiva e quindi possono rappresentare un interessante bersaglio terapeutico.
Conclusioni modifica modifica sorgente
Comprendere le funzioni dei recettori mGlu nel Sistema Nervoso Centrale e Periferico
I Sistemi Nervosi hanno fatto progressi significativi negli ultimi anni. In particolare, il ruolo dei recettori mGlu del Gruppo I (mGlu1 e mGlu5) è stato ampiamente studiato a livello molecolare, cellulare e comportamentale, evidenziando la loro importanza in numerose funzioni fisiologiche e processi patologici. Sia mGlu1 che mGlu5 sono stati implicati in una varietà di disturbi cerebrali, tra cui epilessia, dolore, ischemia e malattie neurodegenerative. Il potenziale di questi recettori di modulare la trasmissione glutamatergica e la loro presenza in diverse aree del cervello potrebbe, quindi, rappresentare un vero obiettivo per il trattamento dei disturbi neurologici.
- ↑ Conn PJ, Pin JP. Pharmacology and functions of metabotropic glutamate receptors. Annu Rev Pharmacol Toxicol. 1997;37:205-37.
- ↑ Conn PJ, Pin JP. Pharmacology and functions of metabotropic glutamate receptors. Annu Rev Pharmacol Toxicol. 1997;37:205-37.
- ↑ Conn PJ, Pin JP. Pharmacology and functions of metabotropic glutamate receptors. Annu Rev Pharmacol Toxicol. 1997;37:205-37.
- ↑ Conn PJ, Pin JP. Pharmacology and functions of metabotropic glutamate receptors. Annu Rev Pharmacol Toxicol. 1997;37:205-37.
- ↑ Conn PJ, Pin JP. Pharmacology and functions of metabotropic glutamate receptors. Annu Rev Pharmacol Toxicol. 1997;37:205-37.
- ↑ Conn PJ, Pin JP. Pharmacology and functions of metabotropic glutamate receptors. Annu Rev Pharmacol Toxicol. 1997;37:205-37.
- ↑ Rothman SM, Olney JW. Glutamate and the pathophysiology of hypoxic--ischemic brain damage. Ann Neurol. 1986 Feb;19(2):105-11.
- ↑ Albin RL, Greenamyre TJ. Alternative excitotoxic hypotheses. Neurology. 1992 Apr;42(4):733-8.
- ↑ Ferrante RJ, Kowall NW, Beal MF, Richardson EP Jr, Bird ED, Martin JB. Selective sparing of a class of striatal neurons in Huntington's disease. Science. 1985 Nov 1;230(4725):561-3.
- ↑ Calabresi P, Centonze D, Pisani A, Sancesario G, Gubellini P, Marfia GA, Bernardi G. Striatal spiny neurons and cholinergic interneurons express differential ionotropic glutamatergic responses and vulnerability: implications for ischemia and Huntington's disease. Ann Neurol. 1998 May;43(5):586-97.
- ↑ Calabresi P, Saiardi A, Pisani A, Baik JH, Centonze D, Mercuri NB, Bernardi G, Borrelli E. Abnormal synaptic plasticity in the striatum of mice lacking dopamine D2 receptors. J Neurosci. 1997 Jun 15;17(12):4536-44.
- ↑ Calabresi P, Centonze D, Pisani A, Bernardi G. Metabotropic glutamate receptors and cell-type-specific vulnerability in the striatum: implication for ischemia and Huntington's disease. Exp Neurol. 1999 Jul;158(1):97-108.
- ↑ Dickenson AH, Chapman V, Green GM. The pharmacology of excitatory and inhibitory amino acid-mediated events in the transmission and modulation of pain in the spinal cord. Gen Pharmacol. 1997 May;28(5):633-8.
- ↑ Battaglia G, Rustioni A. Coexistence of glutamate and substance P in dorsal root ganglion neurons of the rat and monkey. J Comp Neurol. 1988 Nov 8;277(2):302-12.
- ↑ Woolf CJ. Evidence for a central component of post-injury pain hypersensitivity. Nature. 1983 Dec 15-21;306(5944):686-8.
- ↑ Valerio A, Rizzonelli P, Paterlini M, Moretto G, Knopfel T, Kuhn R, Memo M, Spano P. Distribuzione del recettore metabotropico del glutammato mGluR5 nel midollo spinale di ratto e umano: uno studio sullo sviluppo. Neurosci Res. 1997 May;28(1):49-57.
- ↑ Boxall SJ, Berthele A, Laurie DJ, Sommer B, Zieglgansberger W, Urban L, Tolle TR. L'attivazione del recettore metabotropico del glutammato contribuisce all'attività riflessa nocicettiva nel midollo spinale del ratto in vitro. Neuroscience. 1996 Sep;74(1):13-20.
- ↑ Boxall SJ, Berthele A, Laurie DJ, Sommer B, Zieglgansberger W, Urban L, Tolle TR. L'attivazione del recettore metabotropico del glutammato contribuisce all'attività riflessa nocicettiva nel midollo spinale del ratto in vitro. Neuroscience. 1996 Sep;74(1):13-20.
- ↑ Eaton SA, Jane DE, Jones PL, Porter RH, Pook PC, Sunter DC, Udvarhelyi PM, Roberts PJ, Salt TE, Watkins JC. Antagonismo competitivo ai recettori metabotropici del glutammato
- ↑ Salt T, Turner JP. Reduction of sensory and metabotropic glutamate receptor responses in the thalamus by the novel metabotropic glutamate receptor-1-selective antagonist S-2-methyl-4-carboxy-phenylglycine. Neuroscience. 1998 Aug;85(3):655-8.
- ↑ Moroni F, Lombardi G, Thomsen C, Leonardi P, Attucci S, Peruginelli F, Torregrossa SA, Pellegrini-Giampietro DE, Luneia R, Pellicciari R. Pharmacological characterization of 1-aminoindan-1,5-dicarboxylic acid, a potent mGluR1 antagonist. J Pharmacol Exp Ther. 1997 May;281(2):721-9.
- ↑ Maione S, Oliva P, Marabese I, Palazzo E, Rossi F, Berrino L, Filippelli A. Periaqueductal gray matter metabotropic glutamate receptors modulate formalin-induced nociception. Pain. 2000 Mar;85(1-2):183-9.
- ↑ Jackson DL, Graff CB, Richardson JD, Hargreaves KM. Glutamate participates in the peripheral modulation of thermal hyperalgesia in rats. Eur J Pharmacol. 1995 Sep 25;284(3):321-5.
- ↑ de Groet M, van der Kooy D. Sensory neuron specific receptor activation reduces pain in rats. Nature. 2000.
- ↑ Fisher K, Coderre TJ. Hyperalgesia and allodynia induced by intrathecal (RS)-dihydroxyphenylglycine in rats. Neuroreport. 1998 Apr 20;9(6):1169-72.
- ↑ Fisher K, Fundytus ME, Cahill CM, Coderre TJ. Intrathecal administration of the mGluR compound, (S)-4CPG, attenuates hyperalgesia and allodynia associated with sciatic nerve constriction injury in rats.
- ↑ Bhave G, Karim F, Carlton SM, Gereau RW. Peripheral group I metabotropic glutamate receptors modulate nociception in mice. Nat Neurosci. 2001 Apr;4(4):417-23.
- ↑ Bhave G, Karim F, Carlton SM, Gereau RW. Peripheral group I metabotropic glutamate receptors modulate nociception in mice. Nat Neurosci. 2001 Apr;4(4):417-23.
